
已知:①微溶于水。
难溶于水,且能与过量的
生成
。
②常温下,几种物质的。如下表:
物质 | ||||
回答下列问题:

 B . O3分子的球棍模型:
B . O3分子的球棍模型: D . 基态As原子的电子排布式和价电子排布式分别为[Ar]3d104s24p3和4s24p3
D . 基态As原子的电子排布式和价电子排布式分别为[Ar]3d104s24p3和4s24p3
 )是一种非常高效的强氧化性消毒剂。常温下是白色固体,难溶于冷水;合成二氯异氰尿酸钠的反应为
)是一种非常高效的强氧化性消毒剂。常温下是白色固体,难溶于冷水;合成二氯异氰尿酸钠的反应为 
请回答下列问题:
准确称取m g样品,配成100mL溶液,取20.00mL所配溶液于碘量瓶中,加入稀和过量KI溶液,充分反应后,加入淀粉溶液,用c mol/LNa2S2O3标准溶液滴定,滴到终点时,消耗Na2S2O3标准溶液的体积为V mL,则样品有效氯含量为%(
)
 B .
B . 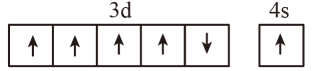 C .
C .  D .
D . 
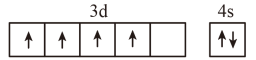
①中Fe3+的杂化轨道类型为(填字母)。
A. B.
C.
D.
②配体SCN-和H2O的键角大小:SCN- H2O (填“<”“>”或“=”。用杂化轨道理论解释,其原因为。
③SCN-中所有原子均满足最外层8电子结构。写出SCN-的电子式。

①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的相对位置,称作原子坐标。如1号原子的坐标为 , 2号原子的坐标为
, 则3号Fe原子的坐标为。
②若晶胞参数分别为apm、bpm、cpm,阿伏加德罗常数的值为NA , 则晶体的密度为 g∙cm-3 (列出计算表达式)。

事实 | 解释 | |
A | 某些金属盐灼烧呈现不同焰色 | 电子从低能轨道跃迁至高能轨道时吸收光波长不同 |
B | CH4与NH3分子的空间构型不同 | 二者中心原子杂化轨道类型不同 |
C | HF的热稳定性比HCl强 | H-F比H-Cl的键能大 |
D | SiO2的熔点比干冰高 | SiO2分子间的范德华力大 |