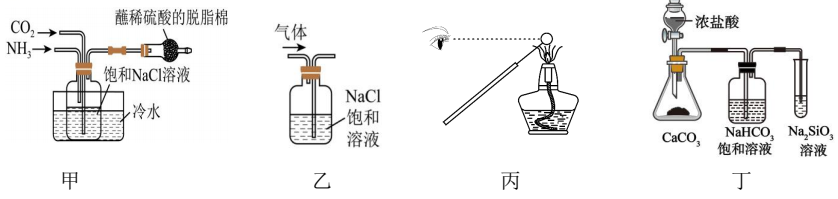
某同学模拟工艺流程,制备碳酸氢钠,实验装置如图所示(图中夹持、固定用的仪器未画出)。
已知:NH3极易溶于水,溶液呈碱性。

请回答:
a.碳酸氢钠难溶于水
b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
操作:取少量试样溶于水中,再滴加。
现象:。
将一定质量的样品与足量的稀硫酸反应,采用如下图所示装置,通过称量反应前后盛有碱石灰的干燥管C的质量,利用其质量差计算样品的纯度。
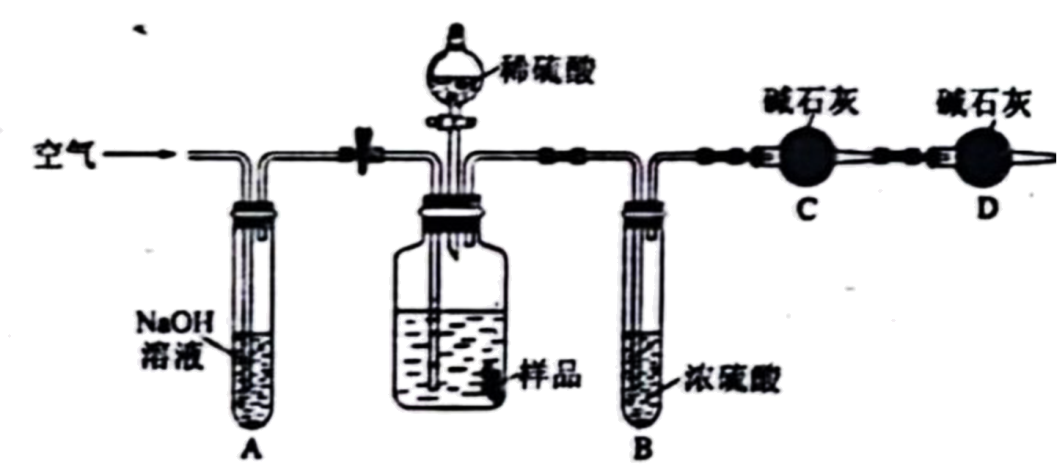
①按照实验顺序排列下列操作步骤gdfch。(某些步骤可以重复)
a.检查装置的气密性 b.打开止水夹 c.缓慢鼓入空气数分钟
d.干燥管C内碱石灰质量为g e.取
g样品装入广口瓶中
f.缓慢加入稀硫酸至不再产生气体为止 g.关闭止水夹
h.称量干燥管C质量为g(
)
②在操作h前,要缓慢鼓入空气数分钟,鼓入空气的作用是,装置A的作用是。
③若去掉装置D,对实验结果的影响是(读“偏大”,“偏小”或“无影响”),样品中的质量分数
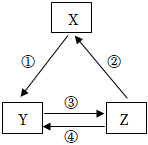
选项 | X | Y | Z | 箭头上为反应条件或试剂 |
A | Fe | FeCl2 | FeCl3 | ①通入少量Cl2 |
B | Na2CO3 | NaCl | NaHCO3 | ③先通NH3、再通CO2 |
C | Na | NaOH | NaCl | ②电解饱和食盐水 |
D | Si | Na2SiO3 | H2SiO3 | ②加热 |

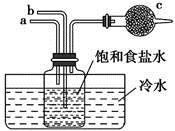
已知NaHCO3在低温下溶解度较小。
反应Ⅰ的化学方程式为。
检验装置B气密性的方法是:塞紧带长颈漏斗的三孔橡胶塞,夹紧两侧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后,若,说明装置不漏气。
a.1861年比利时人索尔维以食盐、石灰石和氨为原料制得了碳酸钠,这种方法叫做氨碱法,也叫索尔维制碱法,其工艺流程如图所示。
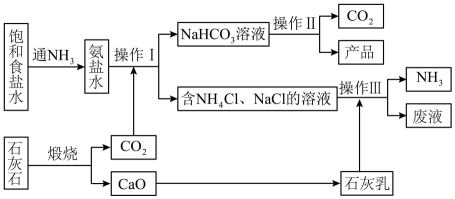

煅烧炉中发生反应的化学方程式为,从母液中提取的副产品为(填化学式)。
c.内蒙古高原天然碱湖主要分布在鄂尔多斯盆地北部、二连盆地中部、巴丹吉林沙漠和海拉尔盆地东南部。面积一般为数平方公里至数十平方公里,多被沙丘所环绕。