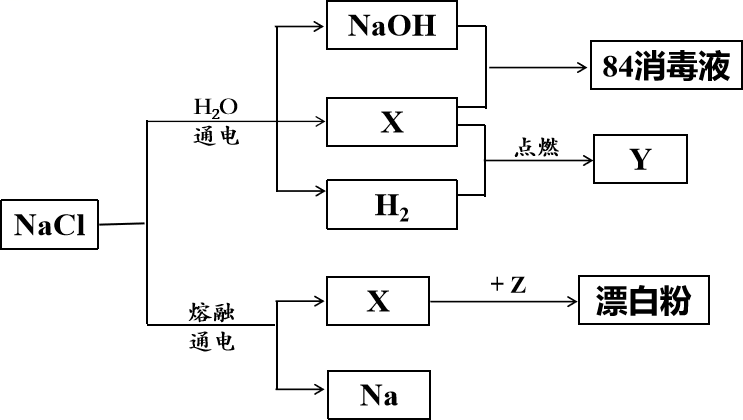

已知NaHCO3在低温下溶解度较小。
反应Ⅰ的化学方程式为。
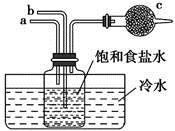
检验装置B气密性的方法是:塞紧带长颈漏斗的三孔橡胶塞,夹紧两侧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后,若,说明装置不漏气。
a.1861年比利时人索尔维以食盐、石灰石和氨为原料制得了碳酸钠,这种方法叫做氨碱法,也叫索尔维制碱法,其工艺流程如图所示。
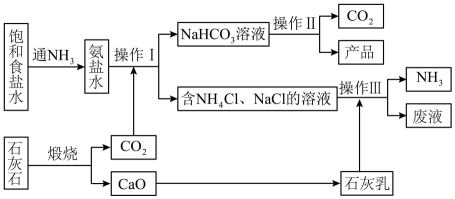

煅烧炉中发生反应的化学方程式为,从母液中提取的副产品为(填化学式)。
c.内蒙古高原天然碱湖主要分布在鄂尔多斯盆地北部、二连盆地中部、巴丹吉林沙漠和海拉尔盆地东南部。面积一般为数平方公里至数十平方公里,多被沙丘所环绕。
|
|
|
|
A.制取CO2 | B.制取NaHCO3 | C.分离NaHCO3 | D.制取Na2CO3 |


①横线上应填写的内容为。
②样品中Na2CO3的纯度为(用含x、y的代数式表示)。
Ⅰ.如图为钠的价类二维图。
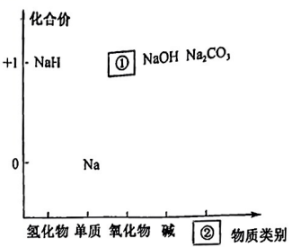
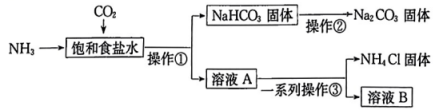
流程图中标注的物质属于电解质的有种,①~③所涉及的操作方法中,包含过滤的是(填序号)。
a.两种气体的先后顺序为先通入再通入
b.先析出的原因是
的溶解度小于
c.整个流程中涉及氧化还原反应
d.溶液B中的主要离子为 ,
,
,