完成下列填空:

写出该反应的化学方程式。
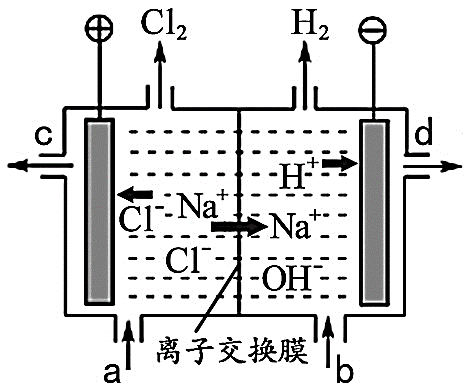
Ⅰ.电解饱和氯化钠溶液的装置如下图。

步骤1:量取10.00 mL氯碱工业所得NaOH溶液,加水稀释并最终配制成1000 mL溶液;
步骤2:量取20.00 mL所配溶液于锥形瓶,加入少量酚酞备用;
步骤3:用 HCl溶液滴定至终点后记录数据并计算。
滴定过程中仪器的选择及读数如下图。

步骤2中量取所配溶液时应选用滴定管(填“A”或“B”)。

提高H2平衡转化率的具体措施为(任写两条);若按投入密闭容器进行反应,平衡时二者转化率关系:
(填“>”“=”或“<”)
。

①催化剂能改变合成氨的(填“活化能”或“反应热”)。
②上述反应历程中决速步骤的方程式为。

①“84”消毒液不可与洁厕灵(主要成分浓盐酸)混合使用会产生一种有毒的气体,请用离子方程式表示该反应.
②实验室要配制的
溶液.所需的玻璃仪器有量筒,烧杯、玻璃棒、、.
③配制过程中,下列操作会导致溶液浓度偏低的是.(填字母序号)
A.称量固体
B.容量瓶使用时未干燥
C.定容时俯视刻度线
D.定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
④将通入冷的烧碱中可以得到
和
, 温度较高时,还会有
生成,若反应生成的
与
的物质的量之比为
, 试从电子守恒角度分析氧化剂与还原剂的物质的量之比为.
①工业上可采用与氯酸钠在硫酸存在条件下反应制取
, 并生成一种酸式盐,写出工业上制取
反应的化学方程式.
②和
都是利用强氧化性来杀菌消毒,
的消毒能力是
的2.5倍(以
氧化剂生成稳定产物时得到的电子数来计算),则
对应的稳定产物是.
