
组别 | 甲 | 乙 | 丙 |
实验示意图 |
|
|
|
能否反应 | 能 | 能 | 能 |
实验现象 | 无明显现象 |
【分析讨论】同学们经过讨论后认为,如果盐酸和氢氧化钙减少(或消失),或者有新物质生成,都能证明反应已经发生。
【查阅资料】CaCl2溶液呈中性。
【实验探究】
方案 | 实验操作 | 实验现象 | 实验结论 |
方案一 | 小羽取少量Ca(OH)2溶液于试管中,先滴入2~3滴无色酚酞溶液,再加入稀盐酸 | Ca(OH)2消失,二者发生了反应 | |
方案二 | 小美向方案一反应后的溶液中加入AgNO3溶液 | 产生白色沉淀 | 有新物质生成,二者发生了反应 |
小凯认为小美的结论不正确,理由是。
Ca(OH)2溶液与稀盐酸发生了化学反应,其反应的化学方程式为。
对于无明显现象的反应,我们可以分析比较反应物和生成物的性质,从多个角度设计实验证明反应已发生。
将少量CO2通入NaOH溶液中也无明显现象,请你设计一个实验方案证明二者发生了反应:(写出操作方法和现象)。

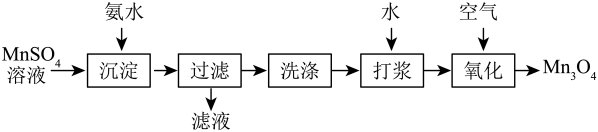
①将钼精矿(MoS2)在高温下焙烧,使MoS2转化为MoO3。
②用氨水浸取,将MoO3转化为钼酸铵【(NH4)2MoO4】。
③钼酸铵【(NH4)2MoO4】溶液与盐酸发生复分解反应,生成钼酸(H2MoO4)。
④把钼酸加热得到MoO3。
⑤在高温条件下,用碳将MoO3还原得到Mo。
请回答:
锶元素(Sr)及其所形成的化合物,在材料生产、油漆加工等领域中具有极其重要的用途。请根据表格中的资料信息和复分解反应规律,回答下列问题。
【查阅资料】锶的部分化合物在水中的溶解性如下:
物质 | Sr(OH)2 | SrCl2 | SrSO4 | Sr(NO3)2 | SrCO3 |
在水中的溶解性 | 易溶 | 易溶 | 难溶 | 易溶 | 易溶 |
方案 | 原料1(写化学式) | 原料2(写化学式) | 制备SrSO4依据的反应规律 |
① | Sr(OH)2 | 碱和酸反应,能生成水 | |
② |