同学们取少量松花蛋粉(用于制作松花蛋泥的原料),加入足量水,搅拌、过滤。在滤液中滴入,滤液变红色,证明滤液中含有碱性物质。
【提出问题】滤液中的碱性物质是什么?
【查阅资料】松花蛋粉中主要含有生石灰、食盐、纯碱(Na2CO3)等。
【分析推理】松花蛋粉加水调和时发生如下反应:
①生石灰与水反应 ,属于(填“吸热”或“放热”)反应;
②(写化学方程式)。
猜想一:只有NaOH;猜想二:有NaOH和Ca(OH)2;猜想三:有。
操作 | 现象 | 结论 |
取滤液少许,向其中加入过量的稀盐酸 | 无明显现象 | 猜想不成立 |
另取滤液少许,向其中加入溶液 | 猜想成立 |
资料1:垃圾焚烧产生的烟气中含有SO2等有害气体;
资料2:FeSO4容易被空气中的O2氧化。

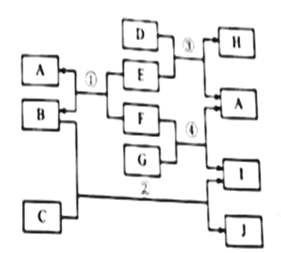
【查阅资料】
①干粉灭火器的主要成分为。
②受热分解生成
、
和
;
受热不分解。
③溶液呈碱性,且不与
溶液发生反应。
【提出猜想】
猜想二:固体成分为(填化学式);
【实验探究】
兴趣小组的同学继续进行实验:
实验步骤 | 实验现象 | 实验结论 |
a.取少量白色固体于试管中,加水溶解,再滴入无色酚酞溶液。 | 溶液呈碱性 | |
b.另取a中溶液于试管中,再滴加足量的 | 发生反应的化学方程式为;固体中含有。 |
【拓展延伸】
上述实验步骤b可用____(填写下列物质的序号)代替溶液。
小乐认为,只进行步骤a即可证明溶液中含有 , 小清认为小乐得出的分析不准确,理由是。
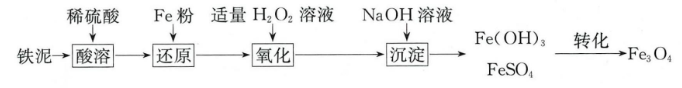
查阅资料:
部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
阳离子 | Mg2+ | Fe2+ | Fe3+ |
开始沉淀时的pH | 9.1 | 7.6 | 1.9 |
沉淀完全时的pH | 11.1 | 9.7 | 3.2 |
请回答下列问题:

实验操作 | 现象 | 结论 |
取样品加水溶解,加入过量稀盐酸至反应完全 | 有产生 | 样品中有NaCl |
向上述溶液中继续滴加适量AgNO3溶液 | 有产生 |
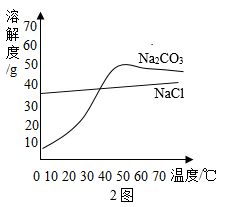
a.CaCl2溶液 b.稀硝酸 c.BaCl2溶液
【方案1】将样品溶解,加入过量CaCl2溶液,搅拌至反应完全。该反应的化学方程式为。过滤、洗涤、干燥,称量沉淀的质量,计算Na2CO3的质量分数。

a.40-10 b.60-30 c.70-40