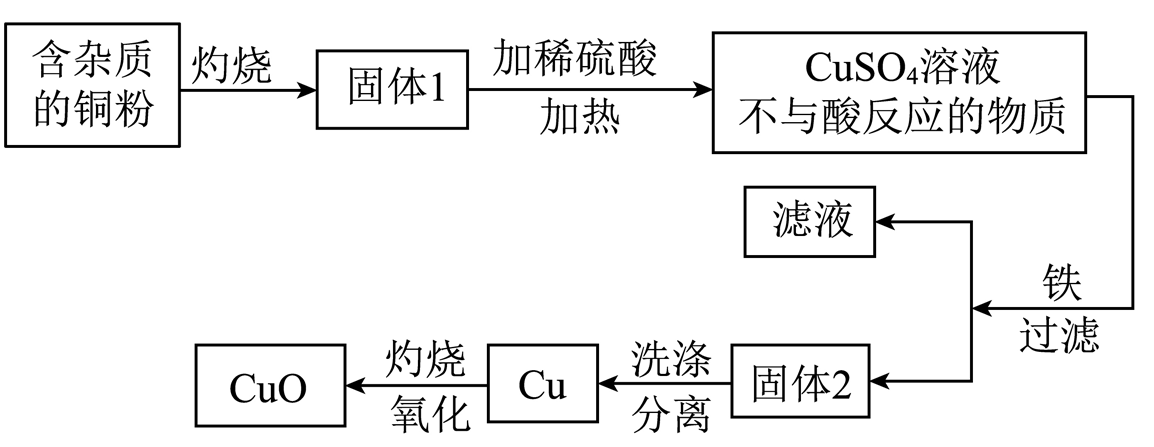
①固体1中加入稀硫酸,若溶液呈蓝色,说明该固体中一定有氧化铜
②固体1中加入稀硫酸,若有红色沉淀物,说明该固体中一定有氧化亚铜


【查阅资料】①KOH与NaOH的化学性质相似。
请用化学方程式解释KOH变质的原因是(用化学方程式表示)。
②K2CO3溶液呈碱性,CaCl2溶液,KCl溶液呈中性。
【猜想假设】假设Ⅰ:只含KOH;假设Ⅱ:含KOH和K2CO3;假设Ⅲ:只含K2CO3.
【进行实验】
实验操作步骤 | 实验现象 | 实验结论 |
a、取少量样品于试管中,加入足量的稀盐酸 | 有气泡产生 | 假设错误 |
b、另取少量样品于试管中,加水溶解,加入过量的CaCl2溶液,振荡,静置 | 产生白色沉淀 | 猜想Ⅱ正确 |
c、取②中上层清液,滴加无色的酚酞试液 |
【拓展应用】完全变质的KOH也有利用价值,从K2CO3的组成或性质看,K2CO3在农业上的可以作为钾肥使用。

①取两个烧杯,各倒入40毫升3%的稀盐酸,分别标为甲和乙。
②甲密封,液体体积不变。乙敞口放置于空气中至液体体积变为20毫升。(溶液密度变化忽略不计)
③向甲、乙中滴加几滴石蕊试液,再分别缓慢滴加相同溶质质量分数的氢氧化钠溶液,恰好完全反应时,消耗的氢氧化钠溶液体积分别为30毫升、26毫升。