
【查阅资料】
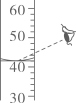
I、(化学性质与
相似)为无色晶体,在冷水中的溶解度比热水中大。
Ⅱ、溶解度随温度变化不大。

 B . 检查装置气密性
B . 检查装置气密性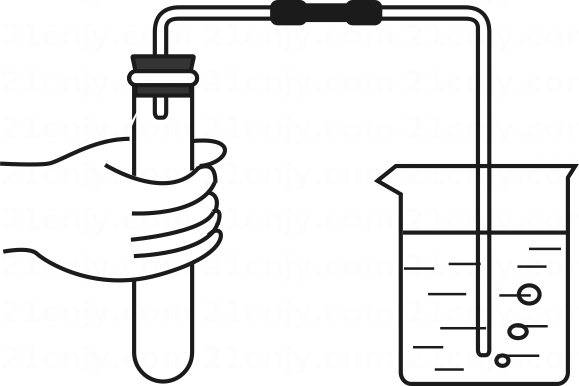 C . 取走蒸发皿
C . 取走蒸发皿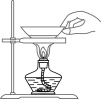 D . 过滤粗盐水
D . 过滤粗盐水

资料1:;碱式碳酸铜受热易分解为三种氧化物;
资料2:回收铜的两种实验方案。
方案①
![]()
方案②
![]()

资料1:Cu2(OH)2CO3+2H2SO4=2CuSO4+3H2O+CO2↑
资料2:回收铜的两种实验方案。





【查阅资料】
请结合以上材料回答下列问题: