

①检验沉淀已洗涤干净的方法是。
②干燥需要在真空干燥箱中进行,不能在潮湿的空气中进行,原因是。
③称取产品和过量的
溶液于锥形瓶中,不断摇动,待固体完全溶解后,用
的
标准溶液滴定至终点,平行滴定三次,消耗
标准溶液分别为
。相关反应如下:
。则产品中
的纯度为(保留三位有效数字)。
A.在250 mL容量瓶中配制250 mL烧碱溶液
B.用移液管(或碱式滴定管)量取25.00 mL烧碱溶液于锥形瓶中并加几滴甲基橙指示剂
C.在天平上准确称取烧碱样品w g,在烧杯中加蒸馏水溶解
D.将物质的量浓度为m mol/L的标准H2SO4溶液装入酸式滴定管,调整液面,记下开始刻度V1 mL
E.在锥形瓶下垫一张白纸,滴定到终点,记录终点刻度为V2 mL
请完成下列问题:

| 锥形瓶中溶液 | 滴定管中溶液 | 选用指示剂 | 选用滴定管 |
A | 碱 | 酸 | 石蕊 | 乙 |
B | 酸 | 碱 | 酚酞 | 甲 |
C | 碱 | 酸 | 甲基橙 | 甲 |
D | 酸 | 碱 | 石蕊 | 乙 |
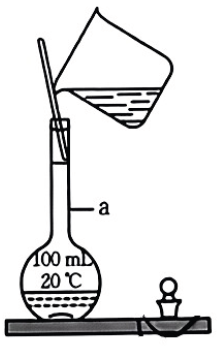
①仪器a的名称为.
②图中错误的地方有处,请指出其中一处:.
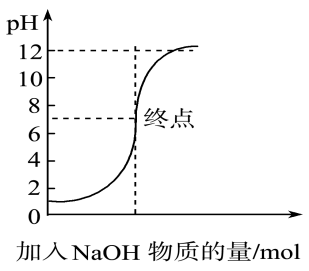
①标准液应盛装在(填“酸”或“碱”)式滴定管中,理由为(用离子方程式表示,写一个即可).
②滴定过程中,眼睛应注视.
③到达滴定终点时的现象为.
④若称取试样
, 消耗
标准溶液
, 则
的质量分数为(用含m、c、V的代数式表示,不考虑操作过程中质量的损失).
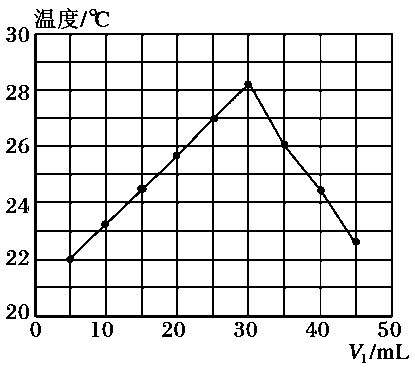
实验用品 | 溶液温度 | 中和热 | |||
t1 | t2 | ΔH | |||
① | 50 mL0.55 mol·L-1NaOH溶液 | 50 mL0.5 mol·L-1HCl溶液 | 20 ℃ | 23.3 ℃ | |
② | 50 mL0.55 mol·L-1NaOH溶液 | 50 mL0.5 mol·L-1HCl溶液 | 20 ℃ | 23.5 ℃ | |
已知:Q=cm(t2-t1),反应后溶液的比热容c为4.18 kJ·℃-1·kg-1 , 各物质的密度均为1 g·cm-3。
①计算完成上表
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:;