 B . 步骤④
B . 步骤④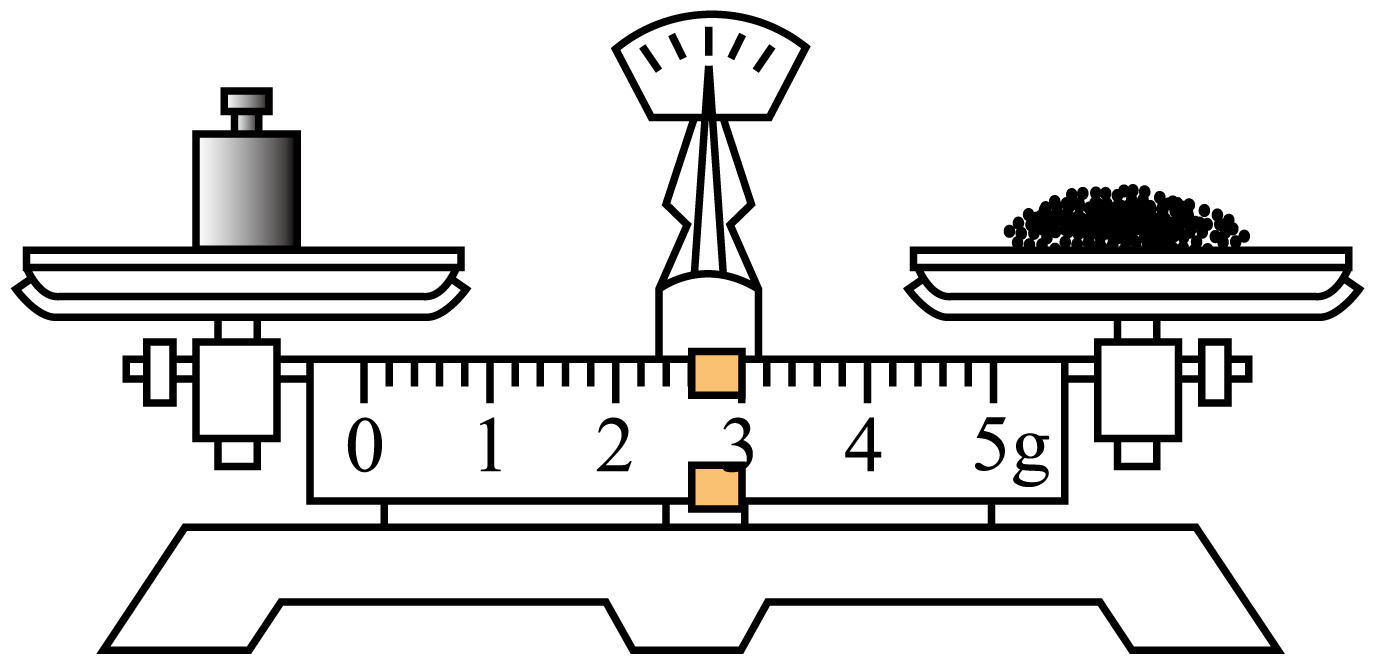 C . 步骤⑤
C . 步骤⑤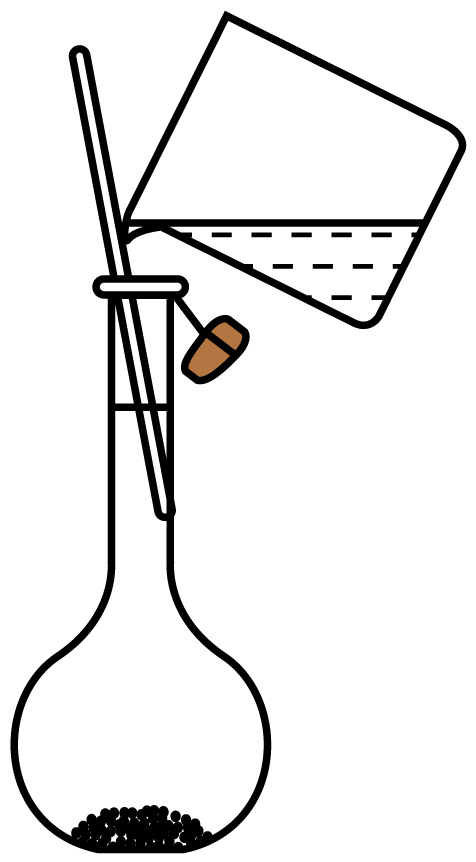 D . 步骤⑥
D . 步骤⑥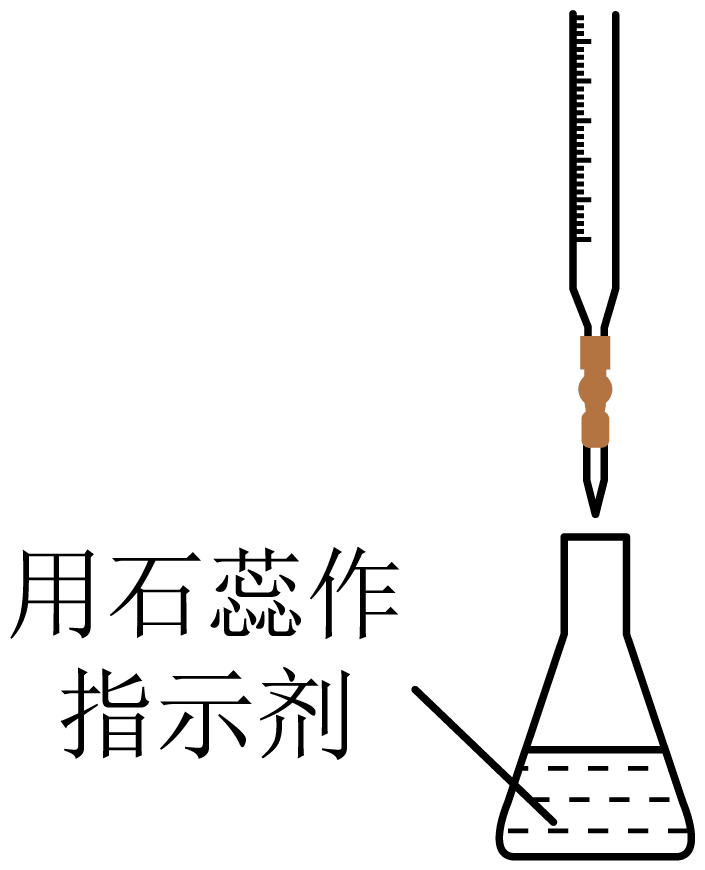
选项 | A | B | C | D |
装置 |
|
|
|
|
现象 | 试管中先出现淡黄色固体,后出现黄色固体 | 产生红褐色沉淀 | 锥形瓶中溶液由无色变粉红色,半分钟不褪色 | 试管中液体变浑浊 |
目的 | 溶解度: AgCl>AgBr>AgI | 制备Fe(OH)3胶体 | 测定醋酸浓度 | 非金属性: Cl>C>Si |

已知:①水浸液的主要成分为、
及少量可溶性的铜、铅化合物等。
②为两性氧化物,微溶于水。
③亚硒酸为二元弱酸,
回答下列问题:
取0.1000g粗硒,加入足量硫酸和硝酸,充分反应生成 , 再加热至90℃使过量的硝酸挥发;继续向
溶液中加入过量的KI溶液,生成Se和
;然后滴入2滴淀粉溶液,用0.4000mol/L
溶液滴定(
)。重复上述操作2次,消耗的
溶液的平均体积为12.50mL。①判断滴定至终点的方法是。
②该粗硒的纯度为。
已知:①三氯化铬能升华,能水解,高温下能被氧气氧化。
②气体有毒,遇水发生水解产生两种酸性气体。
回答下列问题:
以和
(沸点76.8℃)为原料,在高温下制备无水
, 同时生成
气体。选用如下装置(加热及夹持装置略):

①装置E的仪器名称为,装置F中长颈漏斗的作用为。
②实验装置合理的接口连接顺序为a→。
③实验前通入氮气的作用为。装置D中发生反应的化学方程式为。
称取产品配成250 mL溶液,取25.00 mL样品溶液于锥形瓶中,加热至沸腾后加入稍过量
并酸化,将
氧化为
, 再次煮沸,冷却后再加入稍过量KI固体充分摇匀,使铬元素完全以
形式存在。加入适量的指示剂,用
的标准
溶液滴定至终点,平行测定三次,平均消耗标准
溶液23.00 mL(已知
)。
①滴定实验中加入的指示剂为。
②产品中质量分数为。
③下列操作将导致产品中质量分数测定值偏大的是。(填字母标号)
A.加入KI固体量不足
B.加入稍过量反应后未加热煮沸
C.读数时滴定前平视,滴定后俯视
D.用于配制标准液的固体部分变质

步骤1:称取20.00g产品溶于水,配制成100mL溶液备用
步骤2:向一锥形瓶中加入0.03mol碘单质和足量NaOH溶液,发生反应:
步骤3:向锥形瓶中加入10.00mL步骤1配制的溶液,发生反应:
步骤4:待步骤3反应充分后加稀硫酸,发生反应:
步骤5:以淀粉溶液作为指示剂,用1.00的
, 标准液滴定步骤4得到的溶液,发生反应:
, 平行滴定三次,消耗
标准液的平均体积为20.00mL
①判断达到滴定终点的实验现象是。
②产品中硫脲的含量为。
③下列操作会导致测得的硫脲含量偏高的是(填字母)。
A.配制溶液时,所用容量瓶未干燥
B.“步骤4”加入稀硫酸的量不足
C.盛装标准液的试管未润洗
D.滴定开始时俯视读数,达到滴定终点时仰视读数
查阅资料:①锰酸钾()为墨绿色晶体,其水溶液呈深绿色,这是锰酸根(
)
的特征颜色。其在浓的强碱溶液中可稳定存在,碱性减弱时易发生歧化反应。
②一些物质溶解度随温度变化单位:
物质 | ||||||
0 | 20 | 40 | 60 | 70 | 80 | |
28 | 34.2 | 40.1 | 458 | 47.2 | 51.3 | |
2.8 | 6.4 | 12.6 | 22.2 | —— | —— | |
某实验小组设计如下实验步骤用制备
I.高锰酸钾的制备

II.高锰酸钾的提取
III.高锰酸钾的纯度测定
①准确称取样品
, 用容量瓶配成
溶液;②称取高纯度
固体
, 全部置于
锥形瓶中,再加入
溶液和
纯净水后盖上表面皿,于
水浴加热振荡全部溶解;③用以上
溶液趁热滴定。重复②~③,滴定3次。请回答:
a.用少量冰水洗涤 b.先用冰水洗涤,再用乙醇洗涤 c.小火蒸发至析出大量晶体,停止加热
d.小火蒸发至溶液表面出现晶膜,停止加热 e.减压过滤 f.趁热过滤 g.缓慢降温结晶

Ⅰ.磺酰胺的制备

a.碱石灰 b.浓硫酸(填字母) c.P2O5 d.无水CaCl2

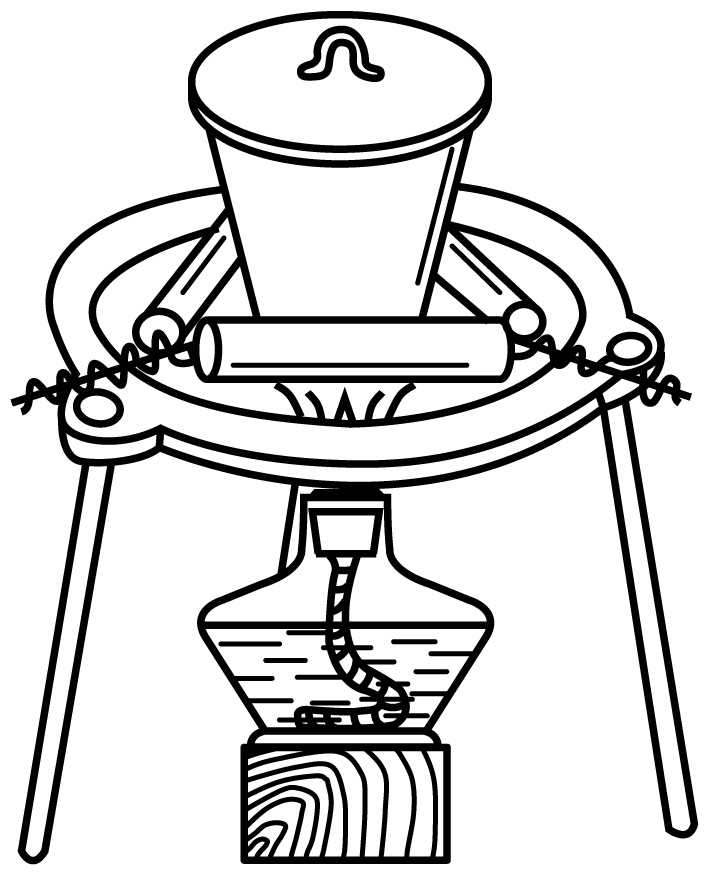
蒸氨:取a g样品进行测定。添加药品后,加热仪器M,蒸出的NH3通入含有V1 mL c1 mol/LH2SO4标准溶液的锥形瓶中。仪器M的名称为,单向阀的作用是。