

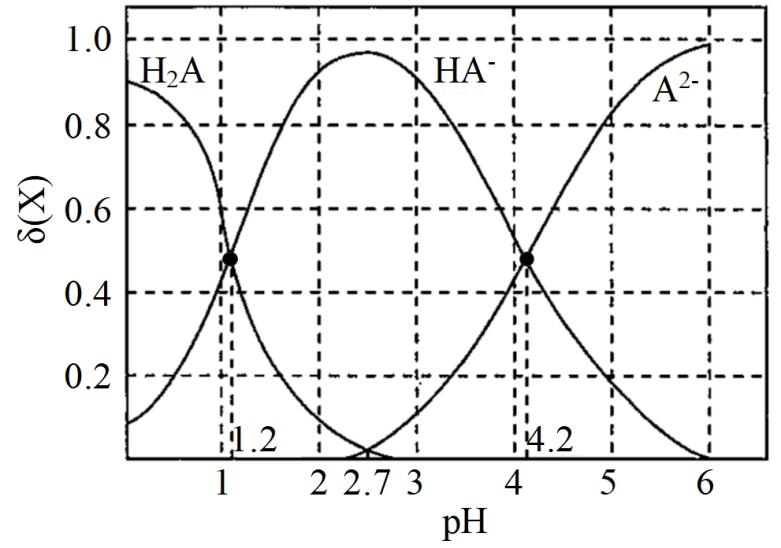
已知:
Ⅰ.光气与水易反应,能溶于溶液;
Ⅱ.有关物质熔沸点如下表。
物质 | ||||
熔点/℃ | 1435 | 1152 | -23 | -118 |
沸点/℃ | 4000 | 1300 | 76 | 8.2 |
①写出加入过量后反应的离子方程式。
②产品中质量分数为,若沉淀完全转变为
溶液后,不继续加热一段时间会导致质量分数(填“偏高”“偏低”或“不变”)。


步骤一:取10.0g样品,加入适量水溶解,配成溶液。
步骤二:将上述所得溶液加水稀释,最后定容至。
步骤三:每次取25.00mL待测液于锥形瓶中,加入1-2滴指示剂,用(硝酸酸化)标准液进行滴定,重复滴定三次。
回答下列问题:


滴定次数 | 待测液体积/mL | 标准溶液的体积/mL | |
滴定前刻度 | 滴定终点刻度 | ||
1 | 25.00 | a | b |
2 | 25.00 | 0.00 | 20.00 |
3 | 25.00 | 0.20 | 20.10 |
第1次滴定终点时读数为;该市售融冰剂中氯化钙的纯度为。
反应原理![]()
![]()
![]()
名称 | 性状 | 相对分子质量 | 熔点(℃) | 沸点(℃) | 密度(g/mL) | 溶解度(g) | |
水 | 乙醇 | ||||||
甲苯 | 无色液体易燃易挥发 | 92 | -95 | l10.6 | 0.8669 | 不溶 | 互溶 |
苯甲酸 | 白色片状或针状晶体 | 122 | 122.4 | 248 | 1.2659 | 微溶 | 易溶 |
苯甲酸在水中的溶解度:0.34g(25℃);0.85g(50℃);2.2g(75℃)。
根据下列实验步骤,回答相关问题:
Ⅰ.制备苯甲酸:在如图所示的三颈烧瓶中放入2.7mL.甲苯和100mL水,控制100℃机械搅拌溶液,加热回流。分批加入8.5g高电动搅拌器锰酸钾,继续搅拌4~5h。

![]() +KMnO4
+KMnO4![]() +MnO2↓+H2O+
+MnO2↓+H2O+

向反应后的混合液中加NaHSO3溶液的目的是。
称取1.220g产品,配成100mL乙醇溶液,移取25.00mL溶液于锥形瓶中,滴加2~3滴酚酞,用KOH标准溶液滴定,消耗KOH溶质的物质的量为2.40×10-3mol。产品中苯甲酸的质量分数为(保留两位有效数字)。若滴定终点俯视读数,所测结果(选填“偏高”、“偏低”、“无影响”)。
①配制100mL一定浓度的溶液需用到的仪器有(填字母)。

②配制溶液时,需要将
固体溶解在浓盐酸中,原因为。
量取10.00mL 溶液于碘量瓶中,加入过量KI溶液,充分反应后加入少量淀粉溶液、再用
标准溶液滴定至蓝色恰好消失,重复操作三次,平均消耗
标准溶液的体积为20.00mL,已知:
, 则该
溶液的浓度为
。
预测现象1:向溶液中加入
溶液,溶液由黄色变为浅绿色。作出该预测的原因为(用离子方程式表示)。
预测现象2:向溶液中加入
溶液,生成红褐色沉淀。
序号 | ⅰ | ⅱ | ⅲ | ⅳ | ⅴ | ⅵ | ⅶ |
2.0 | 2.0 | 2.0 | 2.0 | 2.0 | 2.0 | 20 | |
0 | 1.0 | 2.0 | 5.0 | a | 20.0 | 26.0 | |
38.0 | 37.0 | 36.0 | 33.0 | 23.0 | 18.0 | 12.0 | |
现象 | 溶液接近无色透明 | 出现褐色沉淀 | |||||
pH | 1.7 | 1.7 | 1.7 | 1.8 | 2.8 | 5.4 | 6.2 |
①请补充表格中的数据:a=。
②实验ⅱ~ⅳ中,反应后溶液的pH基本不变,其原因可能是。
③实验ⅵ和ⅶ的实验现象说明溶液中的水解与
的水解相互促进(即发生了双水解反应),请写出反应的化学方程式:。
④甲同学认为实验ⅵ和ⅶ中,与
除发生双水解反应外,还发生了氧化还原反应。请设计实验证明猜想:分别取实验ⅵ和ⅶ中上层清液于两支试管中,(填实验操作与现象),则说明猜想成立。
已知:与KI的反应需要一定时间才能进行得比较完全,故需放置约5 min。
①配制480 mL 0.1 mol/L的标准溶液需要用到的玻璃仪器有:玻璃棒、烧杯、量筒、胶头滴管、。
②将下述实验步骤A到F按实验过程先后次序排列。
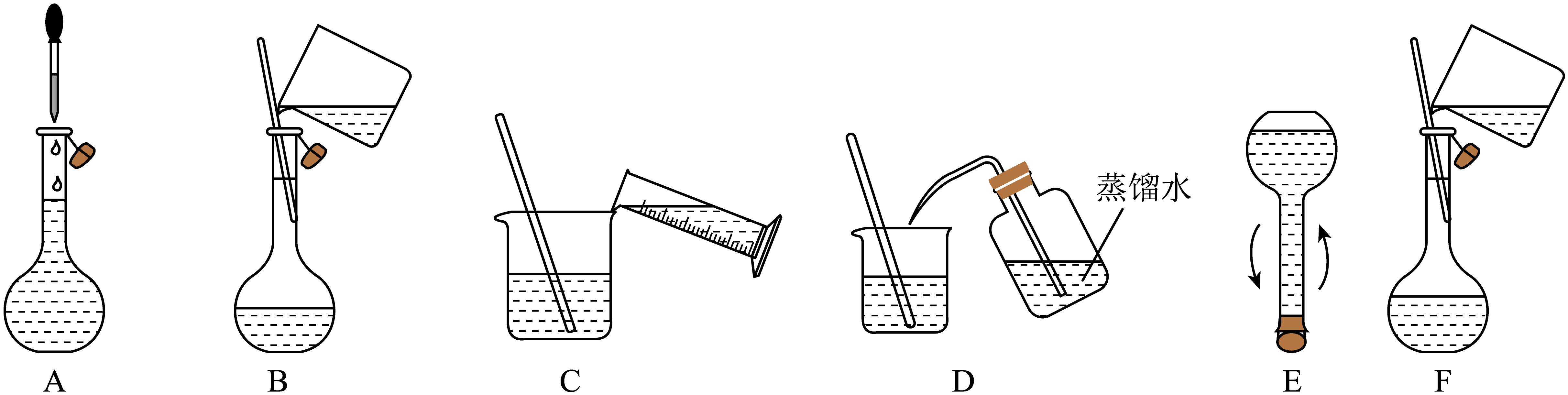
①用量取220.00 mL 0.017 mol/L 溶液。
②加入KI摇匀后用牛皮纸扎紧瓶口的目的是。
③如何判定滴定结束?。
④列式并计算标准溶液
![]() 浓度。
浓度。
| KI溶液 | ||
20.00 mL 0.017 mol/L | 10 mL 100 g/L | 20.35 | |
20.45 | |||
20.40 | |||
21.20 |
①滴定时需加入硫酸。能否用盐酸代替硫酸,为什么?。
②写出溶液与KI反应的离子方程式。
提出问题:与
是可逆反应,
的存在是否会影响滴定?
实验验证:①在磷酸铁锂溶液中加入过量的KI,静置一段时间后,加入KSCN,观察到溶液颜色变红;请写出与
反应的离子方程式:。
②取标准量的磷酸铁锂溶液,分成两组,其中一组加入过量的KI溶液,另一组加入等量的水。再分别使用溶液进行标定,发现消耗的
溶液体积相同。
实验小结:是否会影响滴定:。