已知:CH4(g)+ H2O(g) = CO(g)+3H2(g) ΔH =-206.2kJ·mol-1
CH4(g)+ CO2(g) = 2CO(g)+2H2(g) ΔH =-247.4kJ·kJmol-1
2H2S(g) = 2H2(g)+S2(g) ΔH =+169.8kJ·kJmol-1


化学键 | H―H | C―O | C=O | O―H | C―H |
E/( | 436 | 326 | 803 | 464 | 414 |
则该反应的热化学方程式为。
物质 | ||||
摩尔燃烧焓 | ―393.5 | ―285.8 | ―283 | ―890.3 |
①石墨不完全燃烧生成的热化学方程式为。
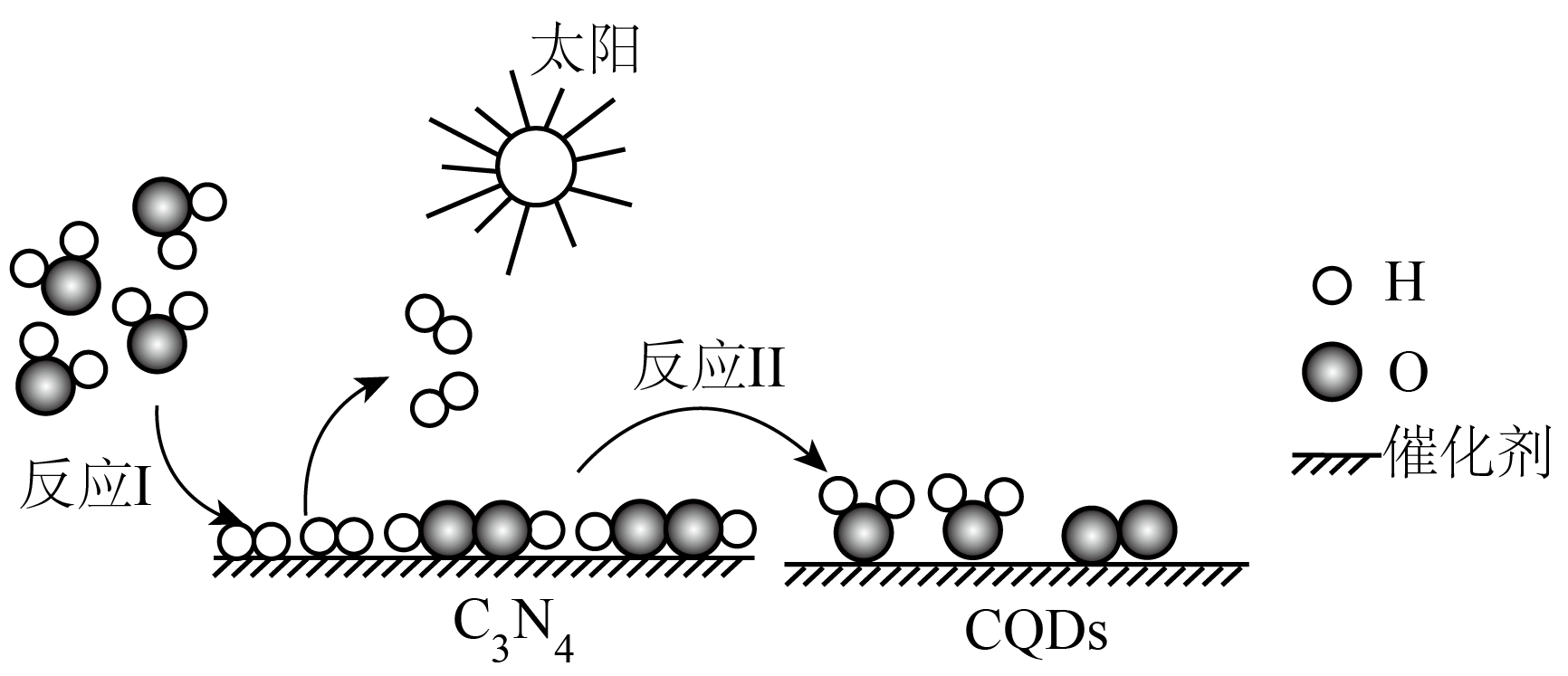
②已知每18g水蒸气转化为液态水释放44kJ的热量,则“萨巴蒂尔反应”的。

①N电极为直流电源的电子(填“流入”或“流出”)极,P电极发生的电极反应式为。
②理论上,该装置每产生13.44L(STP)气体时,转移电子的数目为,I室海水减少的质量为。