查阅资料,计算氧化
脱氢反应的反应热
i.查阅的燃烧热数据(填化学式)
ii.查阅水的汽化热:
利用上述数据,得如下热化学方程式:
反应Ⅰ
反应Ⅱ
反应Ⅲ
①反应Ⅱ自发进行的条件是(填“高温”“低温”或“任意温度”)。
②反应Ⅲ在热力学上趋势大于反应Ⅰ,其原因是。

①图中代表的物质是。
②曲线在250℃之后随温度升高而增大的原因是。
③250℃时,反应Ⅰ的平衡常数=。
①
②
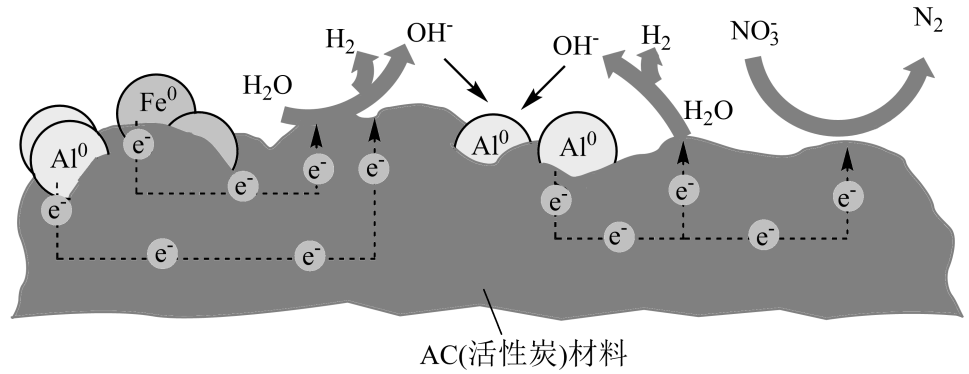
过程①的平衡常数 , 其中
表示溶液中的
浓度,
表示大气中
的分压(单位:kPa)。其他条件不变时,温度升高,
(填“增大”或“减小”);当大气压强为
, 溶液中的
时(忽略
和水的电离),大气中
的体积分数为%(用含
,
、
、
的字母表示)。


|
A |
B |
C |
D |
|
|
|
|
|
|
手机用锂电池 |
电动汽车用电池 |
铅酸蓄电池 |
锌锰干电池 |

总反应:CO(g)+N2O(g) CO2(g)+N2(g) ΔH=kJ·mol-1;该总反应的决速步是反应(填“①”或“②”)

①表示N2O的转化率随的变化曲线为曲线(填“I”或“Ⅱ”);
②T1T2(填“>”或“<”);
③已知:该反应的标准平衡常数 , 其中pθ为标准压强(100kPa),p(CO2)、p(N2)、p(N2O)和p(CO)为各组分的平衡分压,则T4时,该反应的标准平衡常数Kθ=(列出计算式)。
A | B | C | D |
|
|
|
|
制备并收集少量 NO2 | 吸收尾气 Cl2 | 配制 NaCl溶液 | 制备Fe(OH)2 |

已知:碳热还原过程中可能发生下列反应。
i.
ii.
iii.
下列关于碳热还原过程的说法正确的是( )