
工业生成纯碱的第一步是除去饱和食盐水中的、
、
, 依次加入的试剂是 、 、 、过滤、 。备用的除杂试剂有:①足量
溶液;②足量
溶液;③适量稀盐酸;④足量的
溶液。则正确的试剂添加顺序(填字母)。
溶解度(20℃) | 36.0 | 21.7 | 9.6 | 37.2 |
写出装置I中反应的化学方程式:。

①
②
③

上述流程涉及的物质中,属于酸性氧化物的是(填化学式)。

已知氨气极易溶于水,该工艺中若先通入后通入
和,可能造成的后果是。

某同学模拟工艺流程,制备碳酸氢钠,实验装置如图所示(图中夹持、固定用的仪器未画出)。
已知:NH3极易溶于水,溶液呈碱性。

请回答:
a.碳酸氢钠难溶于水
b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
操作:取少量试样溶于水中,再滴加。
现象:。
将一定质量的样品与足量的稀硫酸反应,采用如下图所示装置,通过称量反应前后盛有碱石灰的干燥管C的质量,利用其质量差计算样品的纯度。
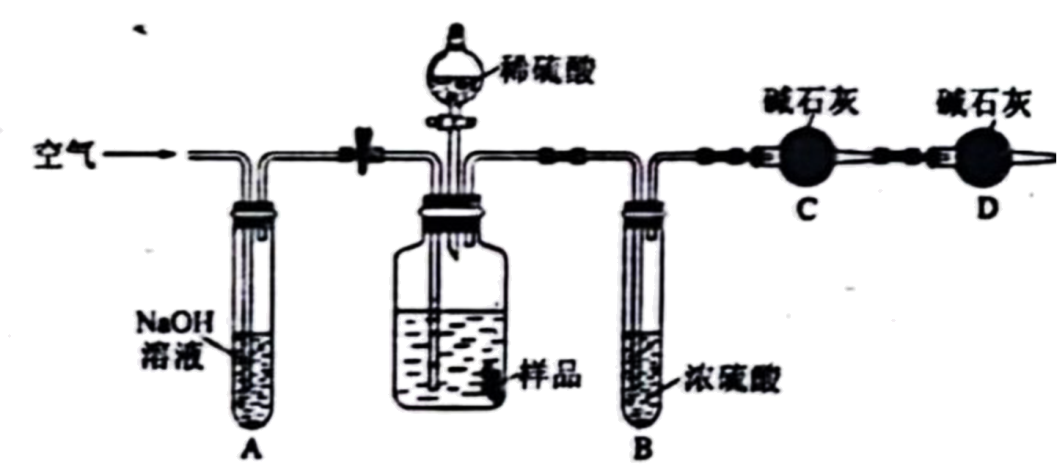
①按照实验顺序排列下列操作步骤gdfch。(某些步骤可以重复)
a.检查装置的气密性 b.打开止水夹 c.缓慢鼓入空气数分钟
d.干燥管C内碱石灰质量为g e.取
g样品装入广口瓶中
f.缓慢加入稀硫酸至不再产生气体为止 g.关闭止水夹
h.称量干燥管C质量为g(
)
②在操作h前,要缓慢鼓入空气数分钟,鼓入空气的作用是,装置A的作用是。
③若去掉装置D,对实验结果的影响是(读“偏大”,“偏小”或“无影响”),样品中的质量分数