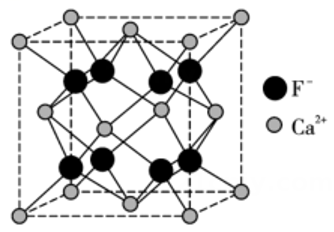
C . 距离A最近且等距离的C有8个
D .
C . 距离A最近且等距离的C有8个
D . 




氮化钼的化学式为,Mo原子周围与之等距离的Mo原子个数为。


①白磷()是分子晶体,易溶于
, 难溶于水,可能原因是。
②黑磷晶体是一种比石墨烯更优秀的新型材料,其晶体是与石墨类似的层状结构,如下图所示。下列有关黑磷晶体的说法正确的是(填字母序号)。

a.黑磷与白磷互为同分异构体 b.黑磷中磷原子采取杂化
c.黑磷能导电 d.黑磷属于混合型晶体
①实验测定磷化铝和磷化铜的熔点分别为2000℃、1070℃,从结构角度说明其熔点差异的原因。
②磷化硼是一种半导体材料,晶胞结构如图所示,磷化硼的化学式是,已知晶胞边长a pm,阿伏加德罗常数为 , 磷化硼晶体的密度是