工业生成纯碱的第一步是除去饱和食盐水中的、
、
, 依次加入的试剂是 、 、 、过滤、 。备用的除杂试剂有:①足量
溶液;②足量
溶液;③适量稀盐酸;④足量的
溶液。则正确的试剂添加顺序(填字母)。
溶解度(20℃) | 36.0 | 21.7 | 9.6 | 37.2 |
写出装置I中反应的化学方程式:。
①验证该混合溶液中含有的方法及现象为。
②NaOH中存在的化学键为。
③将少量的氧化铝投入该混合溶液中,发生反应的化学方程式为。
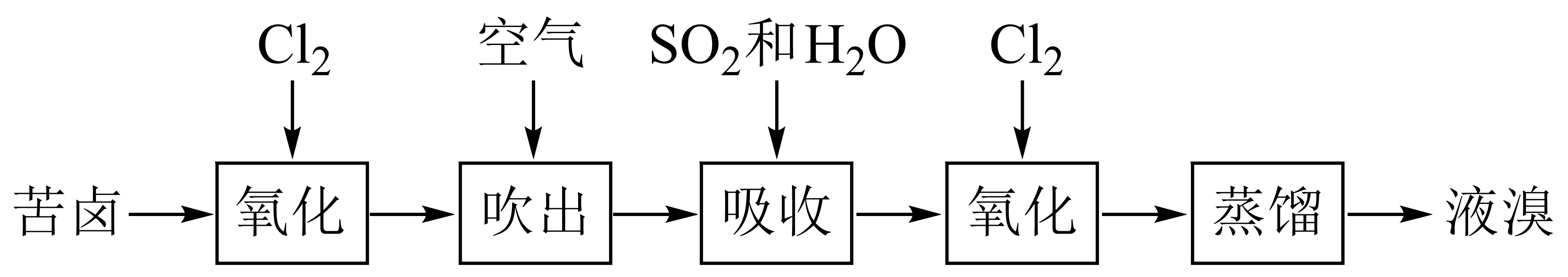
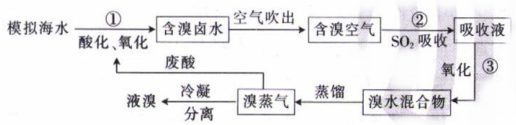
以苦卤为原料提Br2而不是直接利用海水提Br2 , 优势在于。
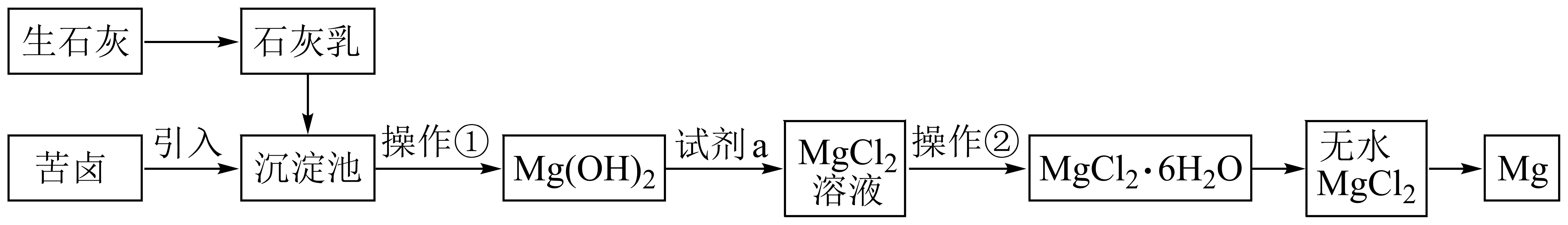
已知:MgO的熔点为2852℃,无水MgCl2的熔点为714℃。
沉淀池中发生主要反应的离子方程式为。
a.N2 b.Ar c.CO2 d.O2
A. B.
C.
D.
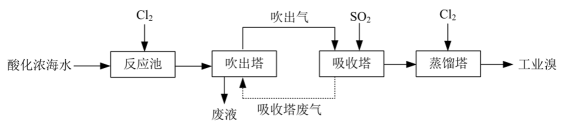
吸收塔中与
反应的离子方程式为。