直接脱氢:
氧化脱氢:
①
②
保持压强为20kPa条件下,按起始投料 , 匀速通入装有催化剂的反应器中发生反应①和②,测得不同温度下
和
的转化率如右图实线所示(图中虚线表示相同条件下平衡转化率随温度的变化)。

表示转化率的曲线是(填“m”或“n”)。

反应Ⅰ:
反应Ⅱ:
在密闭容器中通入3mol 和2mol
, 假设只发生反应Ⅰ和Ⅱ,分别在0.2MPa和2MPa下进行反应,其中
和
的平衡体积分数随温度变化如图所示。

已知:对于反应Ⅱ, ,
,
、
为速率常数,只与温度有关,分压=总压×物质的量分数。下列说法不正确的是( )


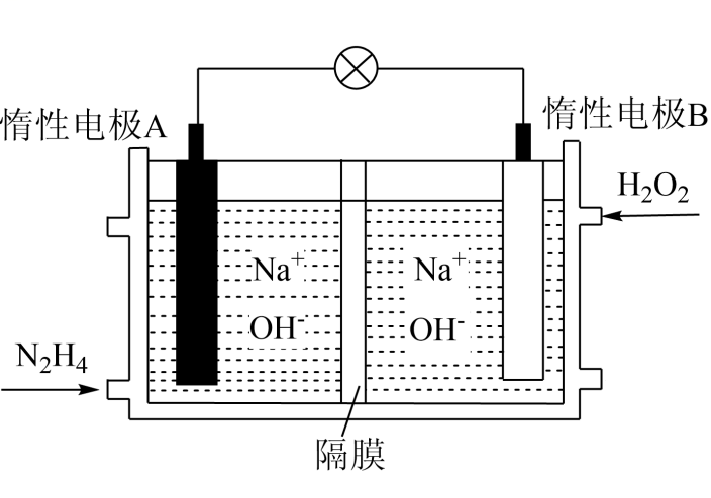
①N2(g)+2O2(g)=N2O4(l) ΔH1=−19.5 kJ· mol−1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH2=−534 kJ· mol−1

t1 min时,反应速率的大小关系为v正 (CO2)v逆 (CO2 )(填“>”“<”或“=”)。


已知:①“碱浸”时,GaAs中Ga以的形式进入溶液。
②离子完全沉淀时的pH:为8,
为5.6。

Pb+PbO2+2H2SO4=2PbSO4+2H2O。
①写出放电时负极的电极反应式: 。
②铅蓄电池放电时,正极质量将(填“增加”、“减小”或“不变”)。当外电路上有1mol电子通过时,溶液中消耗H2SO4的物质的量为。