步骤1:称取20.00g产品溶于水,配制成100mL溶液备用
步骤2:向一锥形瓶中加入0.03mol碘单质和足量NaOH溶液,发生反应:
步骤3:向锥形瓶中加入10.00mL步骤1配制的溶液,发生反应:
步骤4:待步骤3反应充分后加稀硫酸,发生反应:
步骤5:以淀粉溶液作为指示剂,用1.00的
, 标准液滴定步骤4得到的溶液,发生反应:
, 平行滴定三次,消耗
标准液的平均体积为20.00mL
①判断达到滴定终点的实验现象是。
②产品中硫脲的含量为。
③下列操作会导致测得的硫脲含量偏高的是(填字母)。
A.配制溶液时,所用容量瓶未干燥
B.“步骤4”加入稀硫酸的量不足
C.盛装标准液的试管未润洗
D.滴定开始时俯视读数,达到滴定终点时仰视读数
查阅资料:①锰酸钾()为墨绿色晶体,其水溶液呈深绿色,这是锰酸根(
)
的特征颜色。其在浓的强碱溶液中可稳定存在,碱性减弱时易发生歧化反应。
②一些物质溶解度随温度变化单位:
物质 | ||||||
0 | 20 | 40 | 60 | 70 | 80 | |
28 | 34.2 | 40.1 | 458 | 47.2 | 51.3 | |
2.8 | 6.4 | 12.6 | 22.2 | —— | —— | |
某实验小组设计如下实验步骤用制备
I.高锰酸钾的制备

II.高锰酸钾的提取
III.高锰酸钾的纯度测定
①准确称取样品
, 用容量瓶配成
溶液;②称取高纯度
固体
, 全部置于
锥形瓶中,再加入
溶液和
纯净水后盖上表面皿,于
水浴加热振荡全部溶解;③用以上
溶液趁热滴定。重复②~③,滴定3次。请回答:
a.用少量冰水洗涤 b.先用冰水洗涤,再用乙醇洗涤 c.小火蒸发至析出大量晶体,停止加热
d.小火蒸发至溶液表面出现晶膜,停止加热 e.减压过滤 f.趁热过滤 g.缓慢降温结晶

Ⅰ.磺酰胺的制备

a.碱石灰 b.浓硫酸(填字母) c.P2O5 d.无水CaCl2

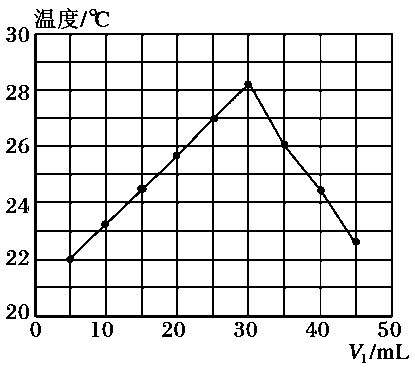
蒸氨:取a g样品进行测定。添加药品后,加热仪器M,蒸出的NH3通入含有V1 mL c1 mol/LH2SO4标准溶液的锥形瓶中。仪器M的名称为,单向阀的作用是。


①检验沉淀已洗涤干净的方法是。
②干燥需要在真空干燥箱中进行,不能在潮湿的空气中进行,原因是。
③称取产品和过量的
溶液于锥形瓶中,不断摇动,待固体完全溶解后,用
的
标准溶液滴定至终点,平行滴定三次,消耗
标准溶液分别为
。相关反应如下:
。则产品中
的纯度为(保留三位有效数字)。

已知:淋洗液太高,EDTA和
会结晶沉淀。
回答下列问题: