过程I:2Fe3O4(s)=6FeO(s)+O2(g) ∆HⅠ =+604.8 kJ·mol-1
过程II:H2O(l)+3FeO(s)=Fe3O4(s)+H2(g) ∆H II
温度 | 氨的含量 | |||||
200 | 15.3 | 81.5 | 86.4 | 89.9 | 95.4 | 98.8 |
300 | 2.20 | 52.0 | 64.2 | 71.0 | 84.2 | 92.6 |
400 | 0.40 | 25.1 | 38.2 | 47.0 | 65.2 | 79.8 |
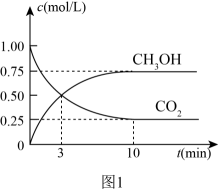
I.CO2(g)+3H2(g)CH3OH(g)+H2O(g),ΔH1=-49.4kJ·mol-1
II.CO2(g)+H2(g)CO(g)+H2O(g),ΔH2
III.CO(g)+2H2(g)CH3OH(g),ΔH3=-90.6kJ·mol-1
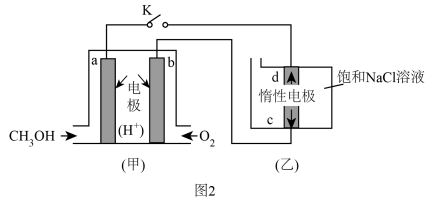
回答下列问题: