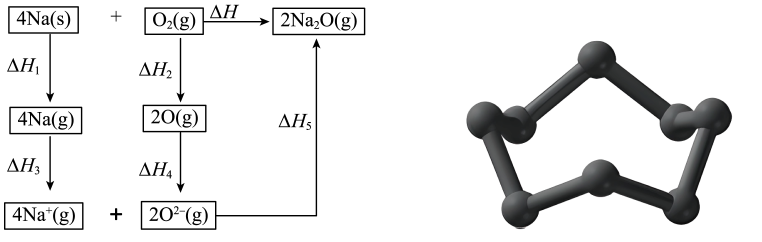
在一定压强下,将和
加入1L容积不变的密闭容器中,已知温度对
的平衡转化率、实际转化率和催化剂催化效率的影响如图1所示,结合图像分析该反应实际反应温度定于250℃的原因可能是.

图1
以合成甲醇涉及的反应如下:
反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
, 反应Ⅲ能自发进行的条件是(填“高温”或“低温”).
图2 图3
图3
已知:选择性
.
①对于以上制甲醇的过程,以下描述正确的是(填序号).
A.反应中经历了、
键的形成和断裂
B.加压可以提高的平衡转化率
C.升高温度可以提高甲醇在平衡时的选择性
②与
混合气体以不同的流速通过反应器,气体流速与
转化率、
选择性的关系如图3.流速加快可减少产物中
的积累,减少反应(用化学方程式表示)的发生,从而减少催化剂的失活,提高甲醇选择性.
化学健 | |||
键能 | 436 | 946 | 391 |
, 该反应自发进行的条件是.
(i) (ii)
(iii)
(iv) (v)
图1 反应机理

图3 图4
下列说法中不正确的是____: