t℃ | 200 | 300 | 400 |
K | K1 | K2 | 0.5 |
请完成下列问题:
①试比较K1、K2的大小,K1K2(填">”、“<”或“=”);
②400℃时,反应2NH3(g)N2(g)+ 3H2(g)的化学平衡常数为。当测得NH3、N2和H2物质的量分别为3mol、2mol和2mol时,则该反应的v(N2)正 v(N2)逆(填“>” “<”或“=”)。
已知:N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-544kJ/mol,键能数据如下表:
化学键 | N-N | N-H | O=O | O-H |
键能/(kJ/mol) | 193 | 391 | 497 | 463 |
则氮氮三键的键能为kJ/mol。

已知部分化学键的键能数据如下:
共价键 | |||||
键能 | 413 | 497 | 462 | 351 | 348 |
根据上述信息,写出该催化反应的热化学方程式。
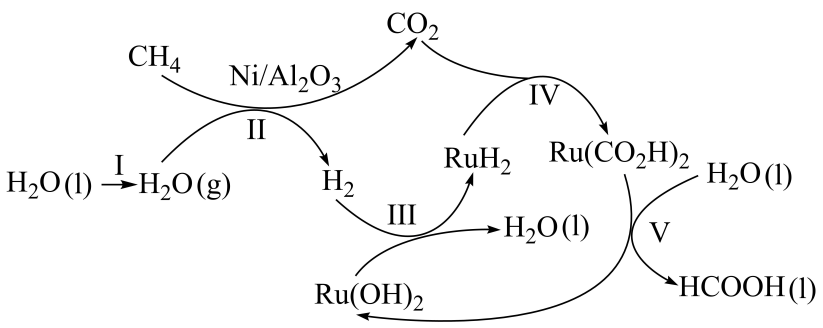
①上述历程中除制得甲酸外,还可得到的副产品为。
②已知上述步骤Ⅱ反应的。一定温度下,向
恒容密闭钢瓶中充入
和
, 在催化剂作用下发生步骤Ⅱ的反应。
末达到平衡,测得钢瓶中
的物质的量为
。
内,平均反应速率
。改变条件重复实验,测得
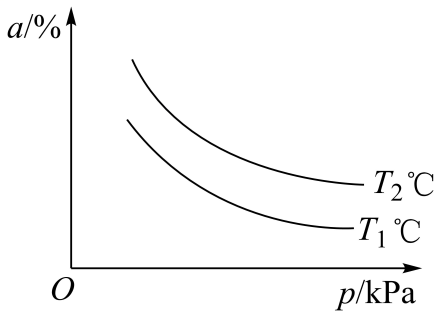
的平衡转化率
与温度
和压强
的关系如图所示,则
(填“>”“<”或“=”)。
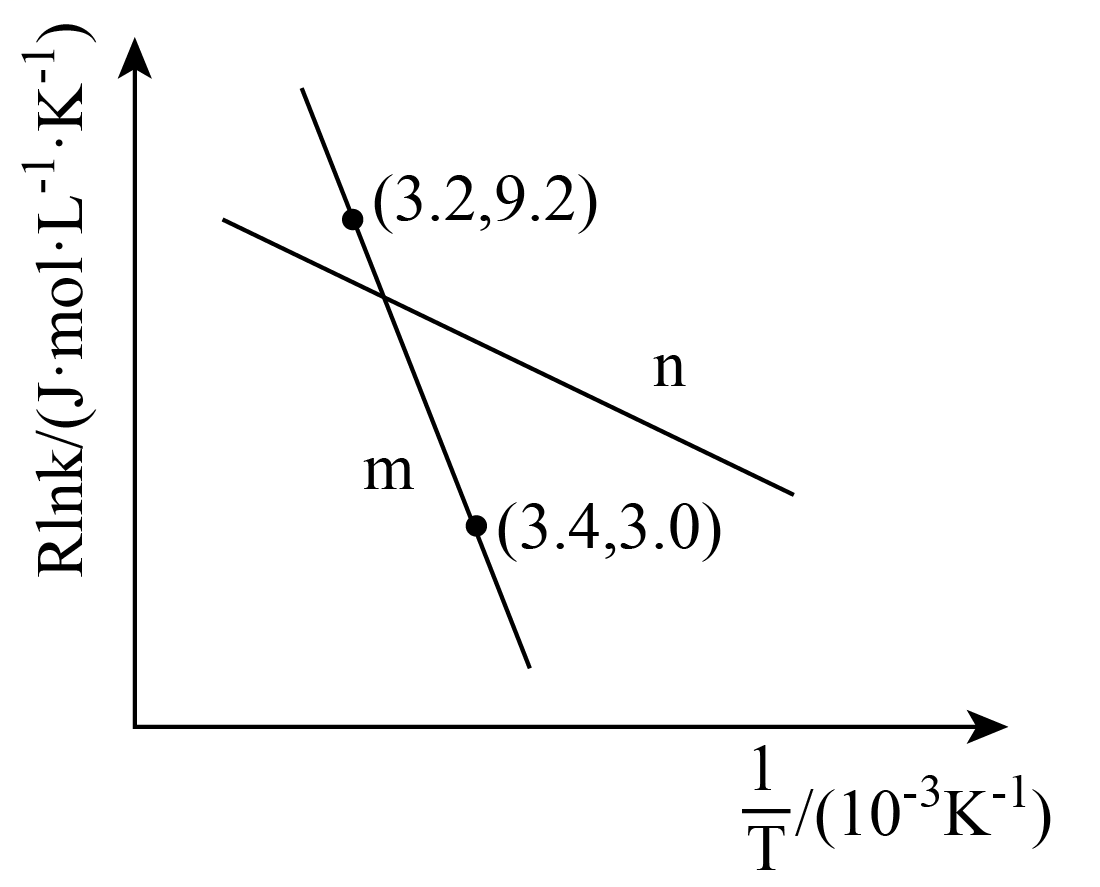

①CO2(g)+3H2(g) CH3OH (g)+H2O(g) ΔH1= -49.4kJ/mol
②CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=+41.2kJ/mol
③CO(g)+2H2(g)CH3OH(g) ΔH3= -90.6kJ/mol
反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。
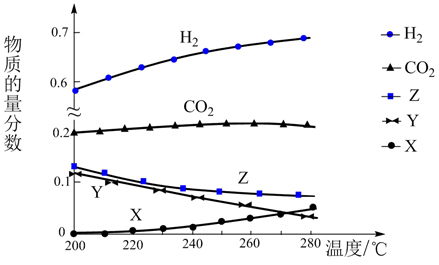
①体系中CO2的物质的量分数受温度的影响不大,原因是。
②如上图X、Y分别代表、(填化学式)。

a. b.容器内压强保持不变
c.容器内密度保持不变 d.