

①甲容器中,内的平均反应速率
。
②甲容器中,A点正反应速率B点的逆反应速率(填“<”“>”或“=”)。
③反应过程中,两个容器温度:甲乙(填“<” “>”或“=”)。
④乙容器中C点时,的物质的量百分数为。
ⅰ.
ⅱ.
ⅲ.
热分解反应
的
(用含
、
、
的式子表示)。
ⅳ.
ⅴ.
根据以上络合反应,下列说法正确的有____(填字母)。

①时,图中含铬微粒按浓度由大到小的顺序为;A点时,溶液中
的平衡浓度为(列出计算式即可)。
②在某电镀工艺中,的浓度需要在
以上,结合计算判断C点所对应的溶液能否用于该电镀工艺(写出计算过程)。

| 图a装置 | 图b装置 | 图c装置 |
80s时反应区 | x |
下列说法正确的是( )
++
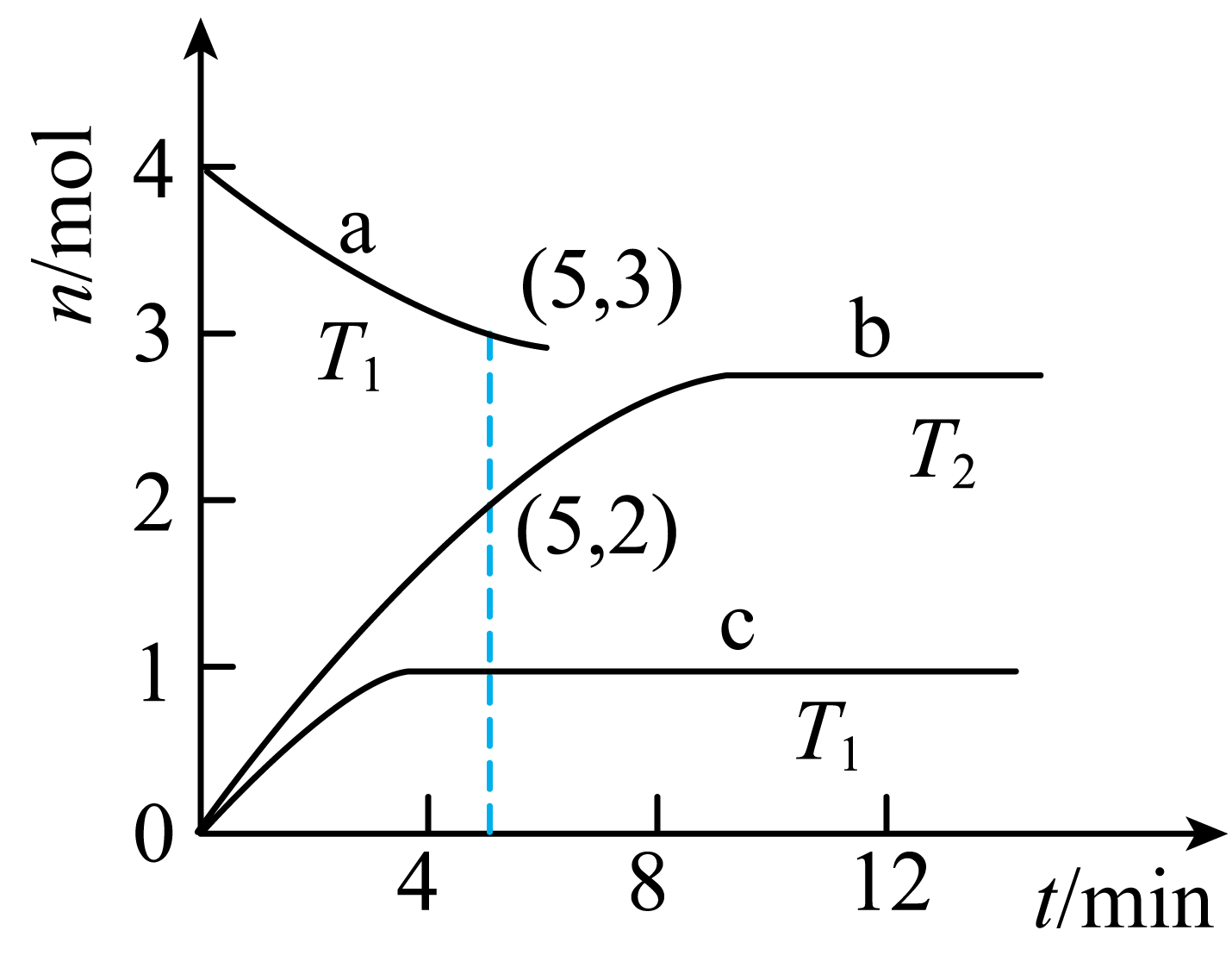
①(填“<”“>”或“=”)。
②在铜-铁催化剂I的作用下,时,
内平均反应速率
。
③上述三种条件下,分解反应的平衡常数的大小关系为
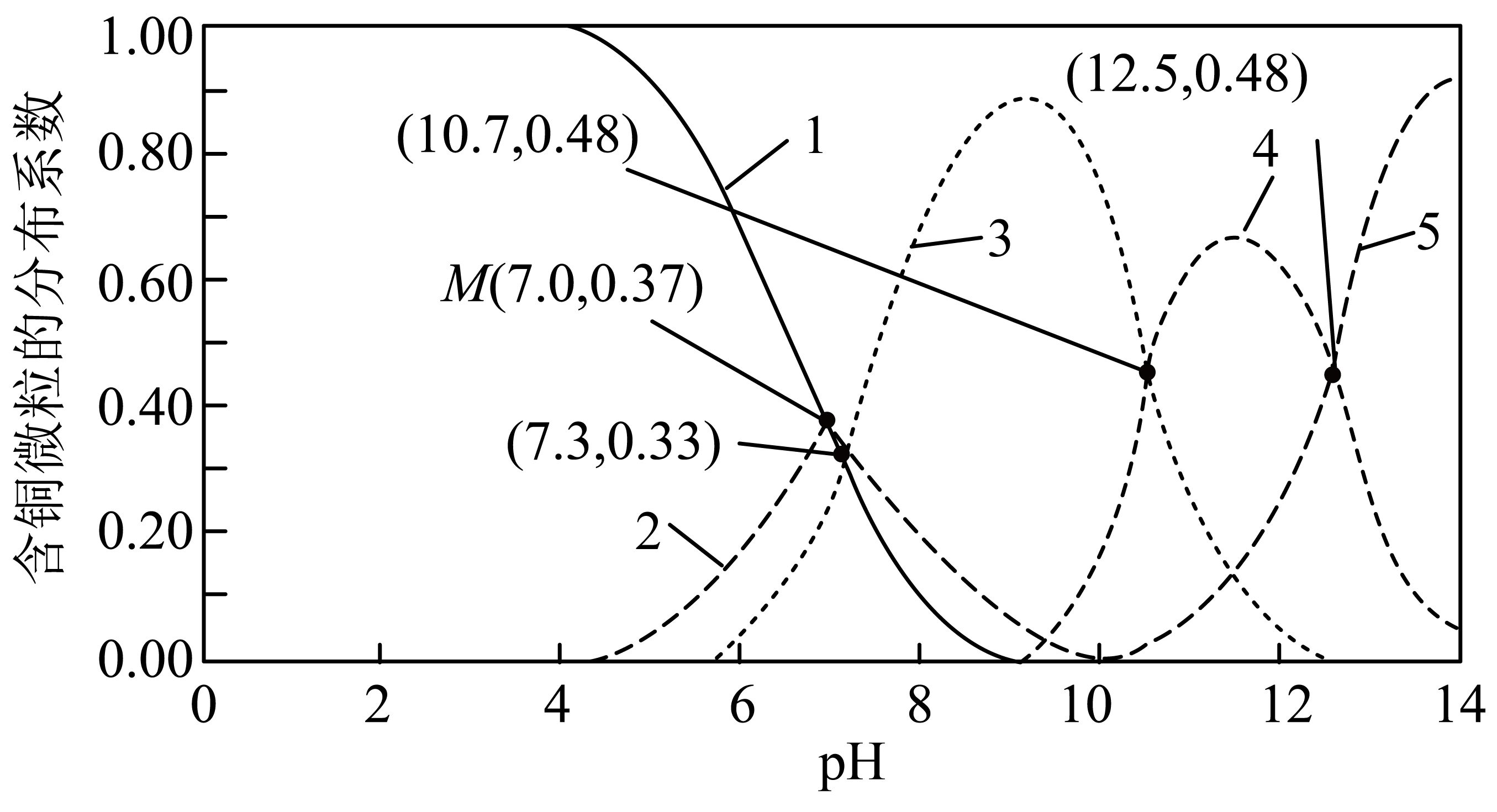
①曲线2代表的含铜微粒为。
②的平衡常数K=。
③若CuSO4溶液起始浓度为 , 加入NaOH固体调节溶液pH(忽略加入固体后引起的溶液体积的变化),求M点混合溶液中Na+的浓度(写出计算过程,结果用含
的式子表示)。
c(H2)/mol·L−1 | c(Br2)/mol·L−1 | c(HBr)/mol·L−1 | 反应速率 |
0.1 | 0.1 | 2 | v |
0.1 | 0.4 | 2 | 8v |
0.2 | 0.4 | 2 | 16v |
0.4 | 0.1 | 4 | 2v |
0.2 | 0.1 | c | 4v |
根据表中的测定结果,下列结论错误的是( )
反应ⅰ:CO(g)+2H2(g)CH3OH(g) △H1=−91.5kJ∙mol−1
反应ii:CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H2=−49.9kJ∙mol−1
反应iii:CO2(g)+H2(g)CO(g)+H2O(g) △H3=+41.6kJ∙mol−1

①CO2的电子式为。
②结合反应历程,写出反应ⅰ中生成甲醇的决速步骤的反应方程式。
③m=(计算结果保留两位有效数字,已知1eV=1.6×10−22kJ)。


①图中表示CH3OH的选择性的曲线是(填“m”“n”或“p”),简述判断方法。

②反应体系中组分CO2(g)、CO(g)的浓度随时间变化情况如图所示。0~15s时间段内,CH3OH的平均反应速率为mol·L−1·s−1(保留两位有效数字)。


1molN―H键断裂吸收的能量等于kJ(保留一位小数),合成氨反应在常温(T=298K)下(填“能”或“不能”)自发进行。

①图甲中反应达到平衡时的平均反应速率。
②图乙的平衡体系中A、B、C三点的平衡常数、
、
间的大小关系是。

①无LiH,催化效率最高的金属是。
②有LiH,反应速率明显增大。文献报道了M―LiH可能的催化历程经如下三步完成。
第ⅰ步:(在M表面解离)
第ⅱ步:
第ⅲ步:。
