
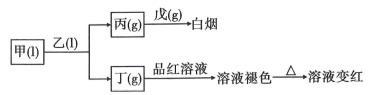
已知:乙、戊分子都含有10个电子,且两种分子中心原子的杂化方式均为杂化,乙中共价键的键角小于戊中共价键的键角。丙易溶于水,0.1mol/L丙的水溶液中,
。甲为三种元素组成的化合物,其他化合物均为两种元素组成的化合物。试回答下列问题:
化学键 | |||||||
键能/ | 411 | 318 | 799 | 358 | 452 | 346 | 222 |
①基态的3d电子轨道表示式为。
②的配位原子是,氨气中H—N—H的键角小于配合物中H—N—H的键角,其原因是。
Ⅰ.
Ⅱ.
①反应
。
②不同温度下氨催化氧化的平衡常数如下();
温度(℃) | 300 | 500 | 700 | 900 | 1100 |
反应Ⅰ( | 6.3×1041 | 1.1×1026 | 21×1019 | 3.8×1015 | 3.4×1011 |
反应Ⅱ( | 7.3×1056 | 7.1×1034 | 2.6×1025 | 1.5×1020 | 6.7×1016 |
下列说法正确的是。
A.如果对反应不加控制,氨和氧气反应的最终产物主要是
B.为使反应有利于向生成更多的NO方向进行,不必关注热力学问题(平衡移动问题),需要关注动力学问题(反应速率问题)
C.在实际生产中,需采用高压氧化,以利于提高NO的产率
D.反应中需控制氨氧比、选择性催化剂的形状、气固相接触时间等
第一步:
第二步:在体积为5 L的密闭容器中加入1 mol 和4 mol
, 在一定条件下反应进行到10 min时,测得
和尿素的物质的量均为0.25 mol,15 min后,测得
的物质的量为0.1 mol,如图所示。
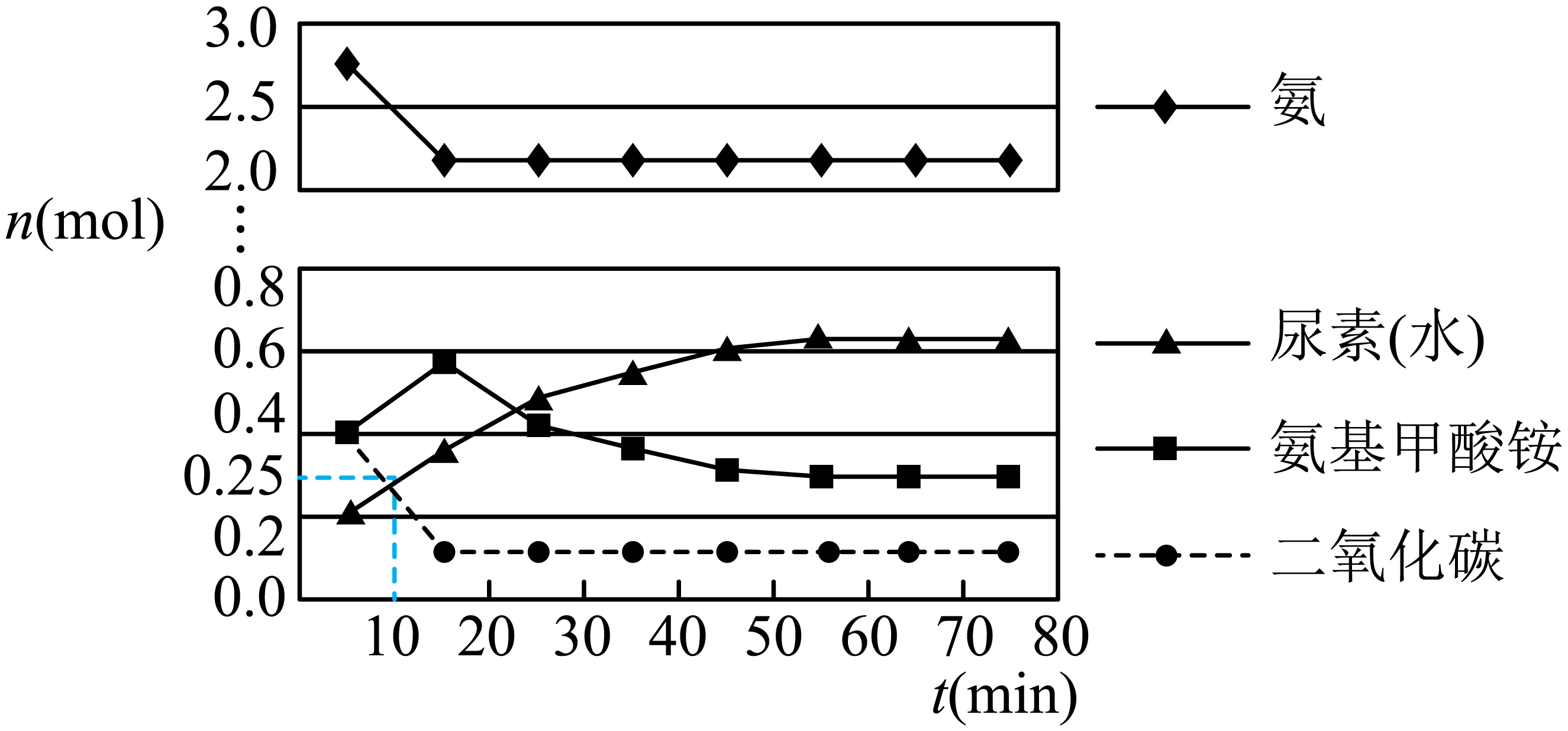
①若用单位时间内物质的量的变化来表示固体或纯液体的反应速率,则10 min内第一步反应中生成(氨基甲酸铵)的平均反应速率为。
②反应进行15分钟后,随着时间的变化,尿素和氨基甲酸铵的物质的量变化比较明显,但氨气和二氧化碳的物质的量基本不变,其主要原因是,第一步反应的平衡常数(列出算式即可)。
。(电负性:
)
下列说法正确的是。
A.原子半径:
B.GaAs为共价晶体,为分子晶体
C.沸点:
D.化学键中离子键成分的百分数:
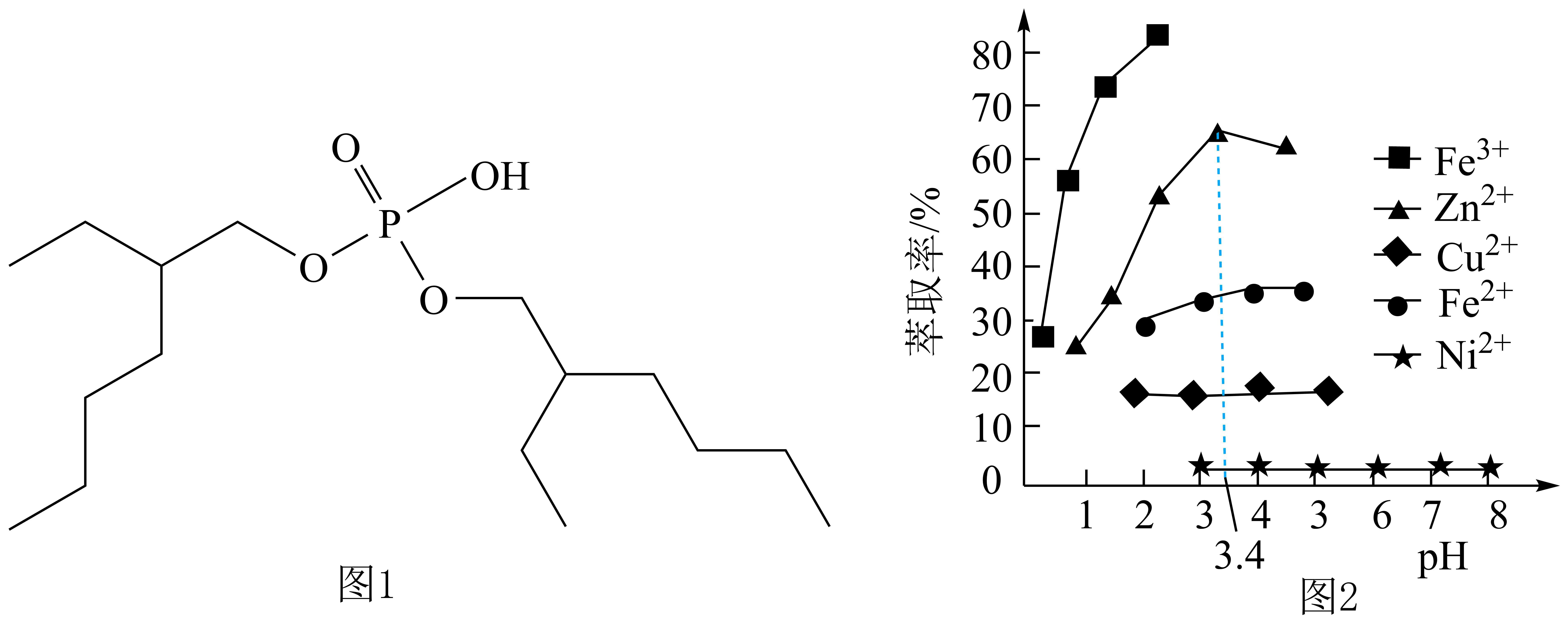
②比较键角:
中的
中的
(填“>”“<”或“=”),请说明理由

如图所示晶胞沿着z轴的投影图为(填选项字母)。
A.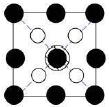 B.
B. C.
C.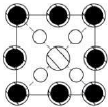 D.
D.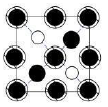
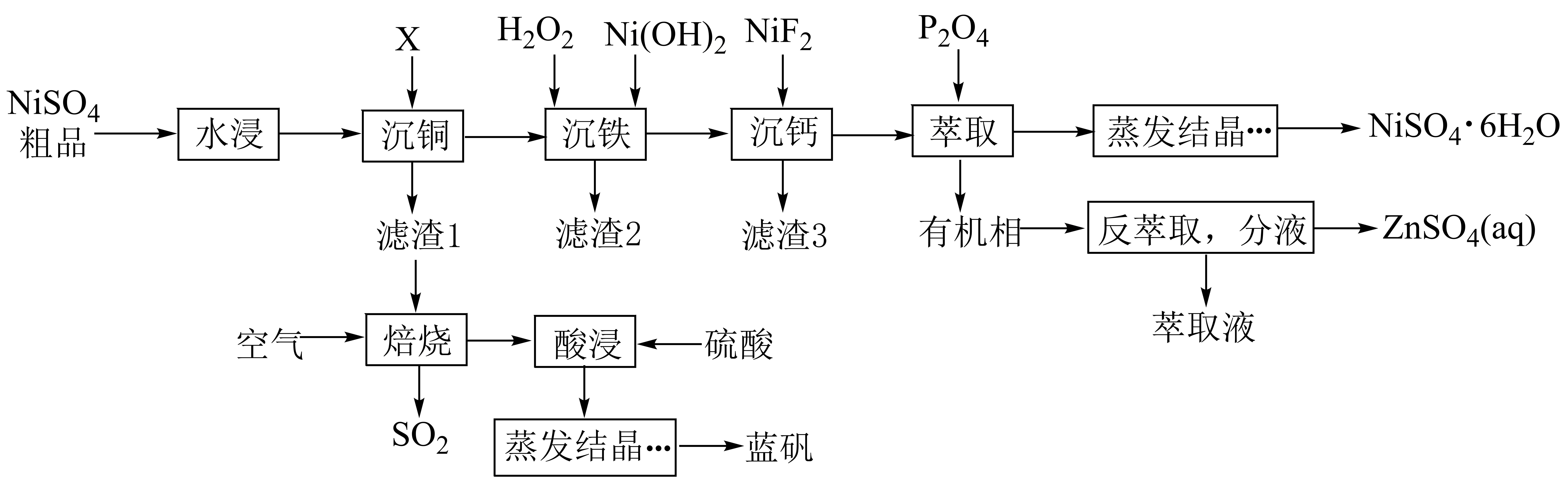
已知:常温下,①;
②部分金属离子(起始浓度为0.1 , 沉淀完全的浓度为
)生成氢氧化物沉淀的pH范围如下表:
金属离子 | ||||||
开始沉淀的pH | 1.5 | 4.2 | 6.2 | 6.3 | 6.9 | 11.8 |
完全沉淀的pH | 2.8 | 6.2 | 82 | 8.3 | 8.9 | 13.8 |
回答下列问题:
A.1.5 B.4.0 C.6.3 D.6.9
| 宏观辨识 | 微观探析 |
A | HF在标准状况下为液态 | HF分子间存在氢键 |
B |
|
|
C | 石墨的导电性只能沿石墨平面的方向 | 石墨晶体中相邻碳原子平面之间相隔较远 |
D | 船式环己烷( | 分子空间结构不同,船式的空间位阻小 |