

①的脱除率高于
, 其原因除
的还原性比
强外,还可能是。
②时,吸收液中烟气转化生成的
和
的物质的量之比为。
研究表明,铁基催化剂在范围内实现
技术的过程如图所示:

根据上述机理,在整个反应过程中的作用为;等物质的量的
在有氧条件下转化为
的总反应化学方程式为。
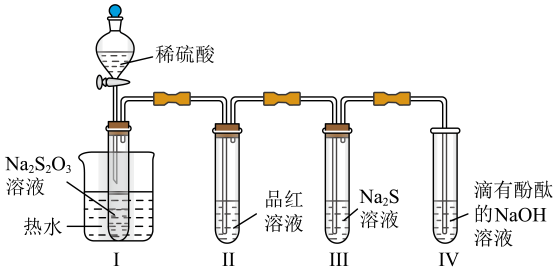

资料:K2FeO4可溶于水、微溶于浓KOH溶液,具有强氧化性,在碱性溶液中较稳定;在酸性或中性溶液中快速产生O2。
①能氧化
, 生成无毒无味气体,补全该反应的离子方程式:
+
+
②结合平衡移动原理解释加入可提高镍元素的去除率的原因:。

步骤1:取a L含废水,浓缩至100mL后,加入过量的
标准溶液,充分反应后过滤,向滤液中加入指示剂,用
标准溶液滴定至
全部转化为
, 消耗
标准溶液的体积为b mL。
步骤2:取100mL蒸馏水,加入与步骤1中等量的标准溶液,加入指示剂,用
标准溶液滴定,消耗
标准溶液的体积为c mL。
①步骤1中加入的标准溶液必须过量,目的是。
②若废水中其他杂质不参与反应,则废水中的含量为
(写出表达式)。

向三颈瓶中通入C发生反应,一段时间后向其中加入适量NaCN溶液,充分反应后可得含有CuCN的浊液。

①写出三颈烧瓶中生成CuCN的总反应的化学方程式:。
②实验结束时向装置中通入 , 该实验操作的目的是。
皿。产品纯度测定
mL于锥形瓶中,加入2滴邻菲罗啉指示剂,立即用
硫酸铈
标准溶液滴定至终点,消耗
溶液bmL。产品中CuCN的质量分数为。(不用化简,用上述字母列出表达式。已知:
)
下列有关滴定的说法错误的是(填字母)。
A.未用标准溶液润洗滴定管会使测定结果偏低
B.锥形瓶要用待测溶液润洗
C.在接近终点时,使用“半滴操作”可提高滴定的准确度
D.滴定前正确读数,滴定后仰视读数,会使测定结果偏低