反应原理![]()
![]()
![]()
名称 | 性状 | 相对分子质量 | 熔点(℃) | 沸点(℃) | 密度(g/mL) | 溶解度(g) | |
水 | 乙醇 | ||||||
甲苯 | 无色液体易燃易挥发 | 92 | -95 | l10.6 | 0.8669 | 不溶 | 互溶 |
苯甲酸 | 白色片状或针状晶体 | 122 | 122.4 | 248 | 1.2659 | 微溶 | 易溶 |
苯甲酸在水中的溶解度:0.34g(25℃);0.85g(50℃);2.2g(75℃)。
根据下列实验步骤,回答相关问题:
Ⅰ.制备苯甲酸:在如图所示的三颈烧瓶中放入2.7mL.甲苯和100mL水,控制100℃机械搅拌溶液,加热回流。分批加入8.5g高电动搅拌器锰酸钾,继续搅拌4~5h。

![]() +KMnO4
+KMnO4![]() +MnO2↓+H2O+
+MnO2↓+H2O+

向反应后的混合液中加NaHSO3溶液的目的是。
称取1.220g产品,配成100mL乙醇溶液,移取25.00mL溶液于锥形瓶中,滴加2~3滴酚酞,用KOH标准溶液滴定,消耗KOH溶质的物质的量为2.40×10-3mol。产品中苯甲酸的质量分数为(保留两位有效数字)。若滴定终点俯视读数,所测结果(选填“偏高”、“偏低”、“无影响”)。
化学键 | H—H | Cl—Cl | O=O | C—Cl | C—H | O—H | H—Cl |
E/(kJ·mol-1) | 436 | 247 | x | 330 | 413 | 463 | 431 |

请回答下列问题:
实验序号 | A溶液 | B溶液 |
① | 20mL 0.1mol·L-1H2C2O4溶液 | 30mL 0.1 mol·L-1KMnO4溶液 |
② | 20mL 0.2mol·L-1H2C2O4溶液 | 30mL 0.1mol·L-1KMnO4溶液 |
该实验探究的是因素对化学反应速率的影响。如图一,相同时间内针筒中所得的CO2体积大小关系是(填实验序号)。


回答下列问题:




| 实验或实验操作 | 现象 | 实验结论 |
A | 用大理石和盐酸反应制取CO2气体,立即通入一定浓度的Na2SiO3溶液中 | 出现白色沉淀 | H2CO3的酸性比H2SiO3的酸性强 |
B | 向某溶液先滴加硝酸酸化,再滴加BaCl2溶液 | 有白色沉淀生成 | 原溶液中含有SO42-、SO32-、HSO3-中的一种或几种 |
C |
| 试管b比试管a中溶液的红色深 | 增大反应物浓度,平衡向正反应方向移动 |
D |
| 左边棉球变为橙色,右边棉球变为蓝色 | 氧化性:Cl2>Br2>I2 |

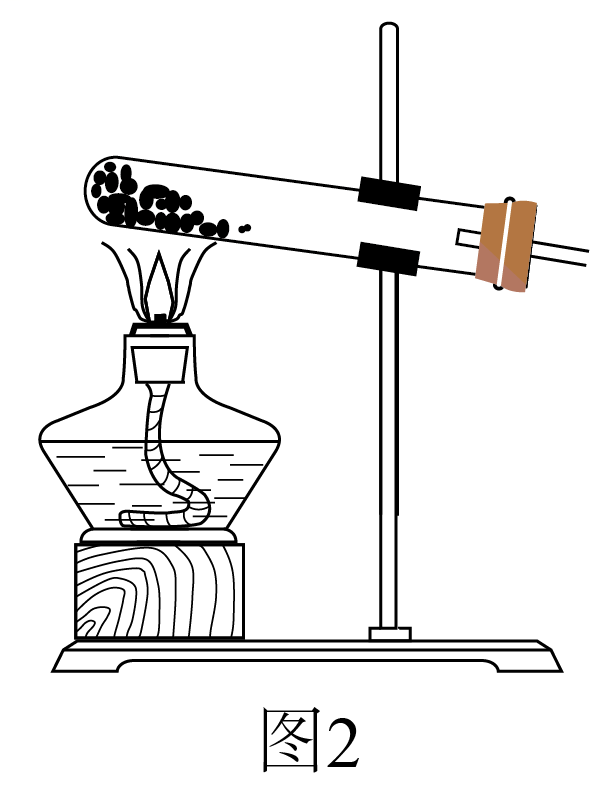
①简述使用分液漏斗向圆底烧瓶中滴加浓硫酸的操作:。
②实验过程中,需要通入氧气。试写出一个用如图2所示装置制取氧气的化学方程式:。
③当停止通入SO2熄灭酒精灯后,需要继续通一段时间的氧气,其目的是:。
④实验结束后,若装置D增加的质量为mg,装置E中产生白色沉淀的质量为ng,则此条件下二氧化硫的转化率是(用含字母的代数式表示,不用化简)。
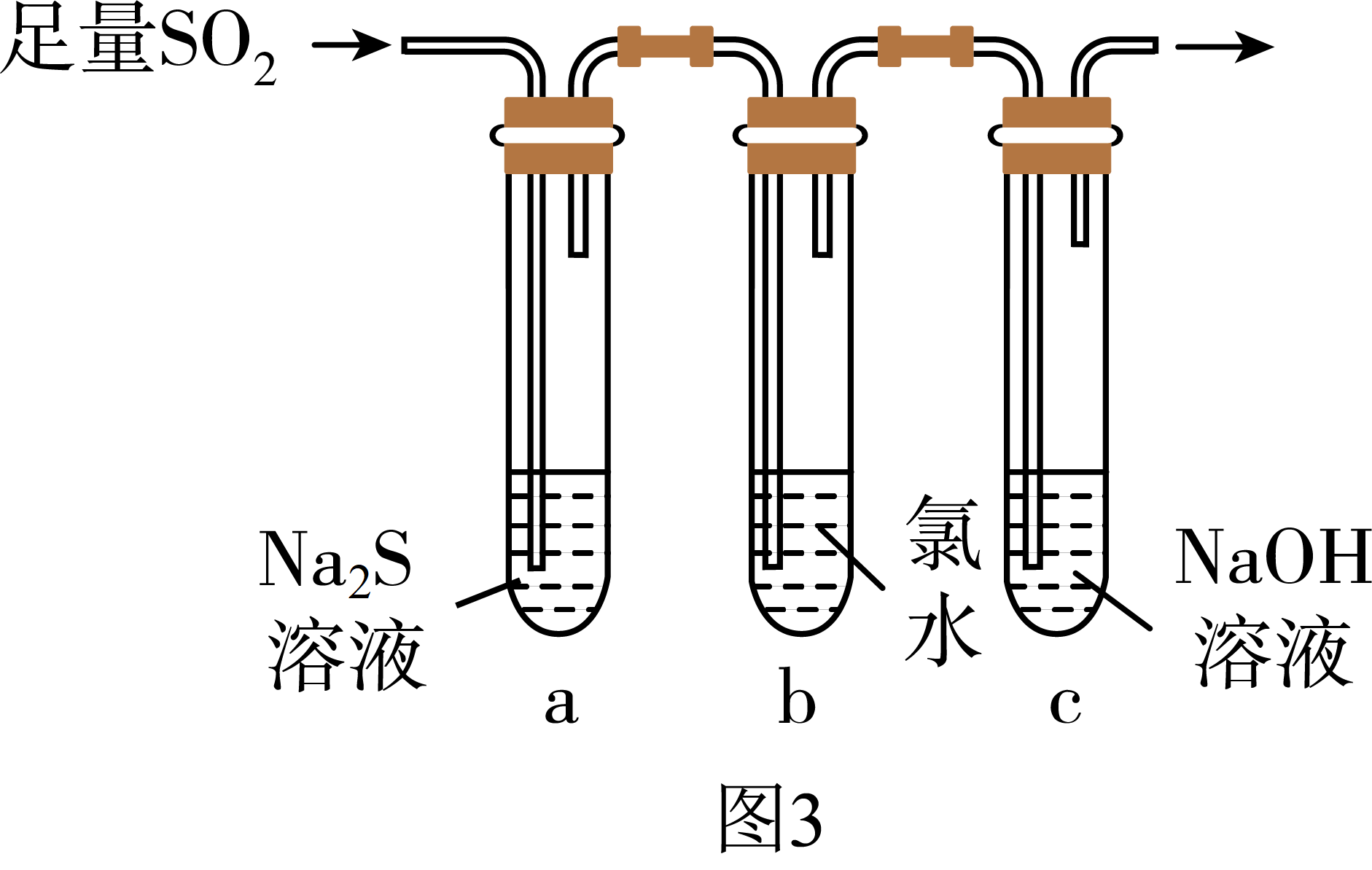
①能说明二氧化硫具有氧化性的实验现象为: 。
②为验证二氧化硫的还原性,充分反应后,取试管b中的溶液分三份,分别进行如下实验。
方案I:向第一份溶液中加入AgNO3溶液,有白色沉
淀生成。
方案Ⅱ:向第二份溶液中加入品红溶液,红色褪去。
方案Ⅲ:向第三份溶液中加入BaCl2溶液,产生白色沉淀
上述方案中合理的是 (填“I”、“Ⅱ”、或“Ⅲ”);
试管b发生反应的离子方程式:。
③当通入二氧化硫至试管c中溶液显中性时,该溶液中
c(Na+)=用含硫微粒浓度的代数式表示)。

, 下列说法正确的是( )(
为阿伏加德罗常数的值)