①N2(g)+2O2(g)=N2O4(l) ΔH1=−19.5 kJ· mol−1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH2=−534 kJ· mol−1

t1 min时,反应速率的大小关系为v正 (CO2)v逆 (CO2 )(填“>”“<”或“=”)。

在一定条件下NH3可将NO2还原。甲同学在实验室对该反应进行了探究。实验设计如图(部分夹持装置省略)。
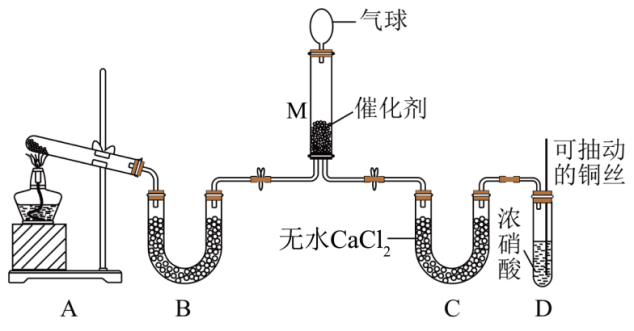
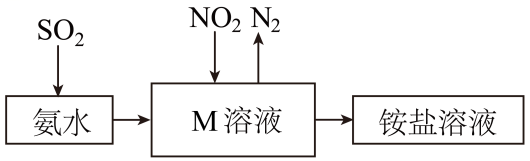
装置D中发生反应的离子方程式是
Pb+PbO2+2H2SO4=2PbSO4+2H2O。
①写出放电时负极的电极反应式: 。
②铅蓄电池放电时,正极质量将(填“增加”、“减小”或“不变”)。当外电路上有1mol电子通过时,溶液中消耗H2SO4的物质的量为。
(i) I2(?)+H2(g)2HI(g) (该反应完全发生,放热9.48kJ)
(ii) I2(?)+H2(g)2HI(g) (该反应完全发生,吸收26.48kJ)