【实验一】粗盐提纯并计算精盐的产率(如图是粗盐提纯的实验操作)。

氯化钠在不同温度下的溶解度数据如下表所示。配制20℃时氯化钠的饱和溶液,需在25g水中至少加入NaClg,在量取水的体积时,应选用(选填“10”、“50”或“100”)mL量筒。
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
NaCl的溶解度/ | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 37.8 |

硝酸钾和食盐的主要成分氯化钠的溶解度数据见下表。
温度/℃ | 0 | 20 | 40 | 60 | 80 | |
溶解度/g | 13.3 | 31.6 | 63.9 | 110 | 169 | |
35.7 | 36.0 | 36.6 | 37.3 | 38.4 | ||
①60℃时,的溶解度为g。20℃时,10g水中最多能溶解NaClg。
②滤液B的质量是g,其中溶液达到(填饱和或未饱和)状态。
③滤液C中的质量是g。为保证步骤Ⅳ没有
析出,步骤Ⅲ最大极限可蒸发g水。
温度/ ℃ | 0 | 10 | 20 | 30 | 40 | 50 |
溶解度/g | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
请回答下列问题:
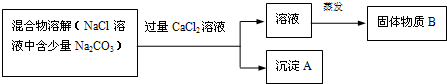
写出沉淀
的化学式 ;
加入
溶液后,分离除去沉淀
的实验操作方法是 ;
上述方案很容易引入新的杂质.于是改进方案:将混合物溶解,若滴加盐酸至不再产生气体为止,则既能除去
杂质,又能有效地防止新杂质的引入.写出有关反应的化学方程式 .
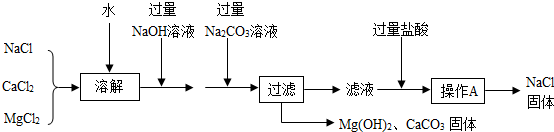

除烧杯和玻璃棒外,还需要的玻璃仪器有、。
A.容量瓶洗净后残留了部分的水
B.转移时溶液溅到容量瓶外面
C.定容时俯视容量瓶的刻度线
D.摇匀后见液面下降,再加水至刻度线


配制溶液 | 步骤 |
Ⅰ | 计算:食盐5g |
Ⅱ | 称量:先把食盐放在左盘,后在右盘加减砝码 |
Ⅲ | 量取:用量程40mL的量筒量取水 |
Ⅳ | 溶解:用玻璃棒搅拌加快溶解 |
粗盐提纯 | 说法 |
Ⅰ | D中玻璃棒的作用是加速溶解 |
Ⅱ | E中滤液浑浊的原因一定是滤纸破裂 |
Ⅲ | D中所获食盐质量比理论低的原因可能是加入水不足,食盐设有完全溶解 |
Ⅳ | A中称量结晶出的食盐时.先把食盐放在左盘,然后在右盘加减砝码 |