![]()

①当加入120gNaOH溶液(即图中B点)时,溶液中的阴离子有(填离子符号)。
②当加入80gNaOH溶液(即图中A点)时,恰好完全反应,通过计算,求此时所得不饱和溶液溶中溶质的质量。(计算结果精确到0.1g)。 (写出解题过程)

氯化钠在海水中的分散微粒是(填微粒符号)。
可以采用物理和化学方法除去粗盐中的MgCl2、CaCl2和Na2SO4等可溶性杂质。
物理方法:用NaCl溶液浸洗粗盐,溶解其中的可溶性杂质,则浸洗溶液应选用NaCl的(填“饱和”或“不饱和”)溶液。
我国科学家侯德榜为我国纯碱和氮肥工业技术的发展做出了杰出的贡献。如图是侯氏联合制碱法和西方索尔维制碱法的工艺流程。(已知.NH4ClNH3↑+HCl↑

利用碳酸氢钠热解生产纯碱反应的基本类型是。
a.无“索尔维氨碱法”中的废弃物CaCl2生成,有利于保护环境
b.大大提高了食盐的利用率,节约了成本
c.析出的晶体可用作复合肥,提高了原料的利用率

如图是“膜分离技术”淡化海水的原理图。该技术采用对海水加压,海水中的水分子可以通过半透膜,而其他微观粒子很难透过。采用膜分离技术淡化海水的原理,与化学实验中常见的操作相似。半透膜上方的海水加压后,海水中溶质的质量分数会(填“增大”、“减小”或“不变”)。

20℃海水中主要盐类及其溶质的质量分数
盐类 | 质量分数 |
NaCl | 2.72% |
MgCl2 | 0.38% |
MgSO4 | 0.17% |
①晒盐时不能将水全部蒸干,目的是使卤水中的NaCl大量析出,而其他盐类基本不析出,请结合两幅图分析其他盐类不析出的原因。
②用“花水”冲洗粗盐,既可除去表面的MgSO4和MgCl2杂质,又不损失NaCl,则“花水”应当是(填序号)。
A.蒸馏水 B.饱和NaCl溶液
C.饱和NaOH溶液 D.饱和BaCl2溶液
海水还可制备金属镁,主要物质转化关系如图所示:

①我国有丰富的石灰石资源,实际生产中,从经济角度考虑常选用作为沉淀剂。
②电解熔融MgCl2制备金属镁时需要保护气的原因是。

①粗盐净化成精盐水的过程中需要除去MgCl2、Na2SO4、CaCl2等杂质,若用化学沉淀法依次除去这三种物质,可采用的方法是(用化学方程式表示,只写一个反应即可)。
②步骤Ⅱ发生的反应是NH3+CO2+NaCl+H2O=NaHCO3↓+NH4Cl,下列叙述正确的是(填字母代号)。
A.该条件下NaHCO3的溶解度比NH4Cl的大
B.配制饱和氯化钠溶液时,可通过搅拌来提高食盐的溶解度
C.向饱和氯化钠溶液中先通氨气的作用是使溶液呈碱性,促进二氧化碳的吸收
D.析出晶体后剩余溶液中溶质只有NH4Cl
③根据步骤III可推测碳酸氢钠具有化学性质。
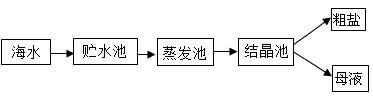

(1)图中①是 池,结晶池分离出来的母液属于NaCl的 (选填“饱和”或“不饱和”)溶液。
(2)步骤②中要除去粗盐中不溶性杂质,通常采用的操作方法 。
(3)固体C的化学式 ;步骤④属于 (吸热或放热)反应。步骤⑤发生的化学反应方程式 。
(4)步骤⑥加入的试剂B的名称 。



①试剂X为(填字母序号)。
A.NaOH B.KOH C.NaNO3
②滤渣中的物质为(填写物质化学式)。
③加适量盐酸的作用是为了除去(填写物质化学式)。

①通常状况下,NH3的溶解度远大于CO2的溶解度。为了提高产率,吸氨碳化塔中应该先通入的是(填“NH3”或“CO2”)。
②吸氨碳化塔中温度控制在30℃~35℃,发生反应的化学方程式为。
③该流程中能循环利用的物质是。(填化学式)
海洋是巨大的资源宝库
海洋是化学资源宝库,含有80多种元素,钠和氯是其中含量较高的元素。海水中存在大量的氯化钠、氯化镁、氯化钙等盐类物质,生活中的食盐主要来自海洋。
海洋蕴含着丰富的油气资源。我国南海中南部油气地质资源量占我国总储量的53%,可采资源量占66%。西沙群岛、中沙群岛的水下有上千米的新生代沉积物,是大有希望的海底石油和天然气产地。天然气主要成分甲烷的含碳量相对较少,燃烧较完全,燃烧产生的二氧化碳比起煤和石油制品相对较少,通常被称为“清洁能源”。