原料 | 反应条件、组成或结构改变 | 效果 | |
A | 碳素钢 | 改变合金元素 | 得到性能不同的特种钢 |
B | 高分子聚合物 | 增加强亲水基团 | 产生高吸水性树脂 |
C | 头发 | 二硫键的断裂与形成 | 定型成需要的形状 |
D | 苯酚、甲醛 | 控制反应条件,主要生成2,4,6-三羟甲基苯酚中间体 | 得到线型结构酚醛树脂 |

, 下列说法正确的是( )(
为阿伏加德罗常数的值)
实验目的 | 实验方案设计 | 现象 | 结论 | |
A | 探究 | 向 | 溶液变蓝色 | 氧化性: |
B | 比较 | 常温,测定 | 结合 | |
C | 探究温度对化学平衡的影响 | 将 | 加热后溶液为黄绿色,冷水中变为蓝绿色 | 说明降低温度
|
D | 比较AgCl与 | 向含有浓度均为 | 先生成白色AgCl沉淀 | Ksp: |
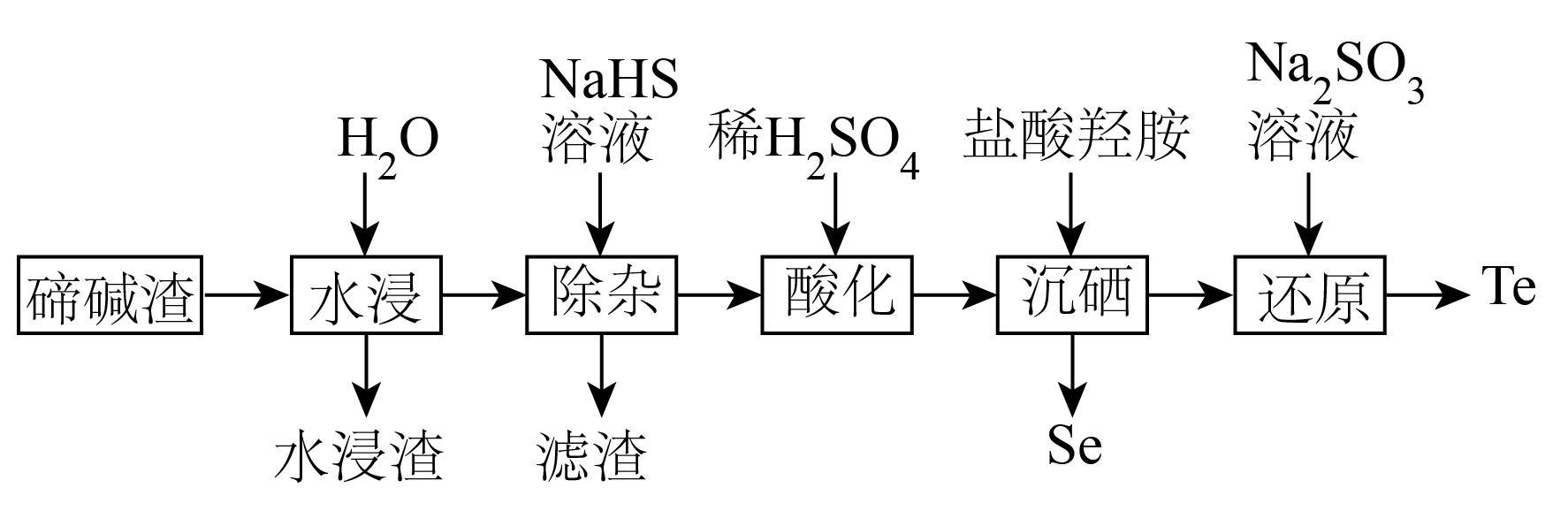
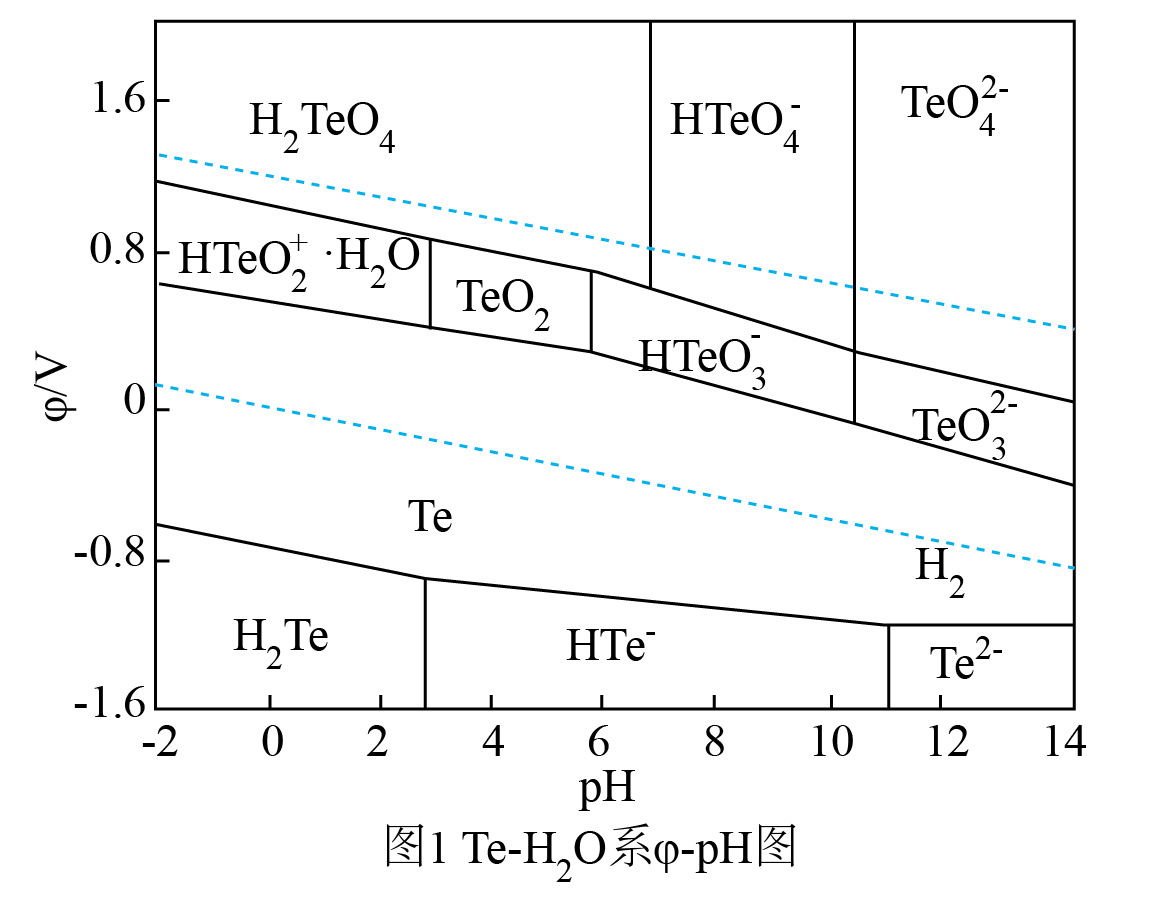
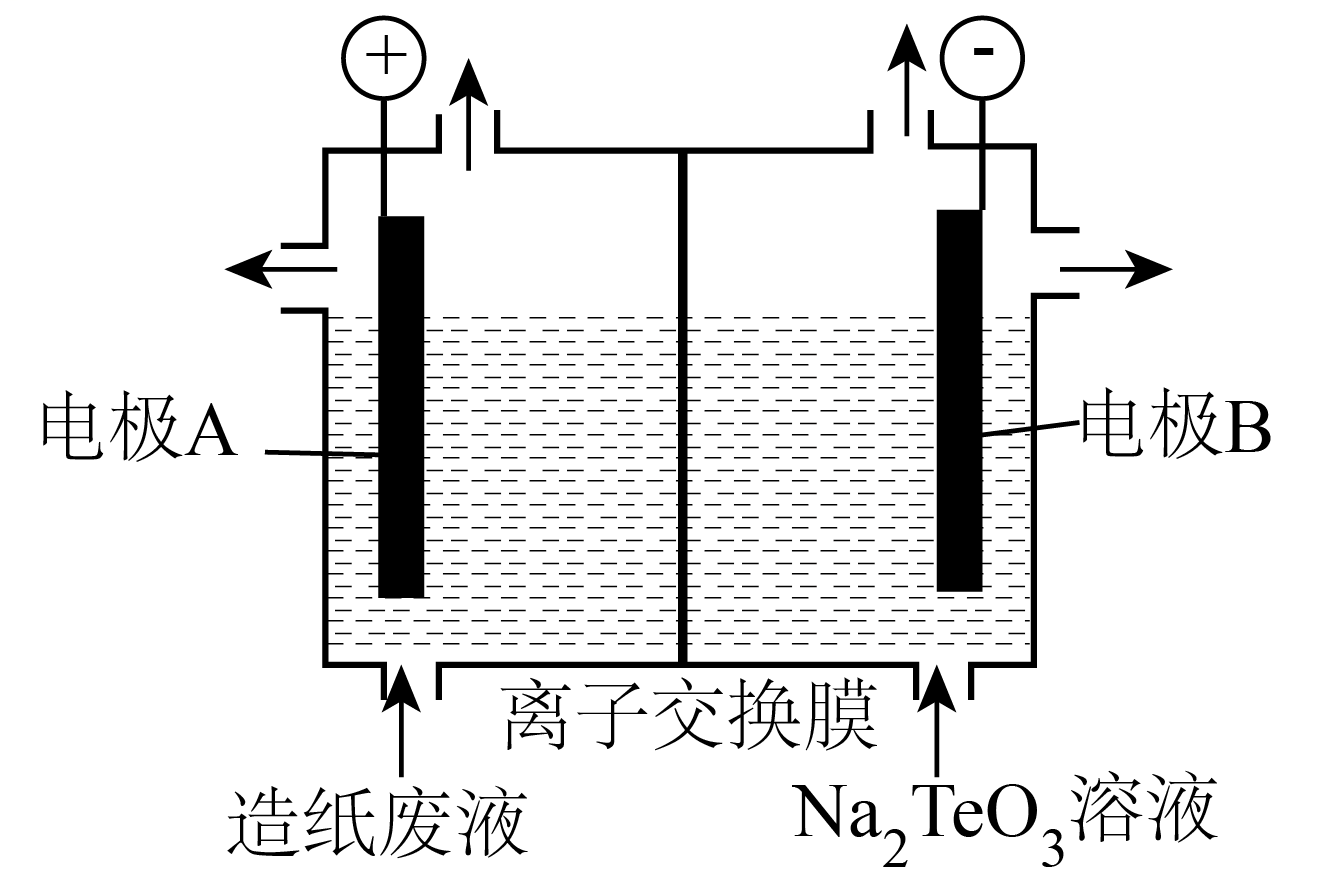
已知:①时溶度积常数:
②当c(Mn+)≤1.0×10-5mol/L时认为离子已经沉淀完全
③盐酸羟胺(NH2OH·HCl)是一种还原剂,其氧化产物是
回答下列问题: