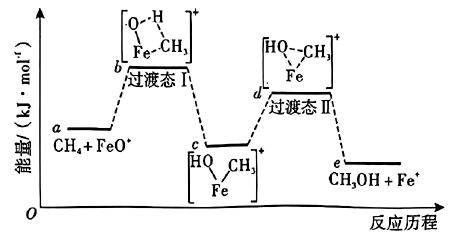
说明:过渡态中“--”表示化学键未完全断裂或形成。
机理Ⅰ:C2H6→CH3CHO
机理Ⅱ:C2H6→CH3CH2OH→CH3CHO
机理Ⅲ:C2H6→C2H4→CH3CHO
已知下图是乙烷选择氧化生成乙醛的一种反应历程的过渡态、中间体和产物的稳定几何构型。
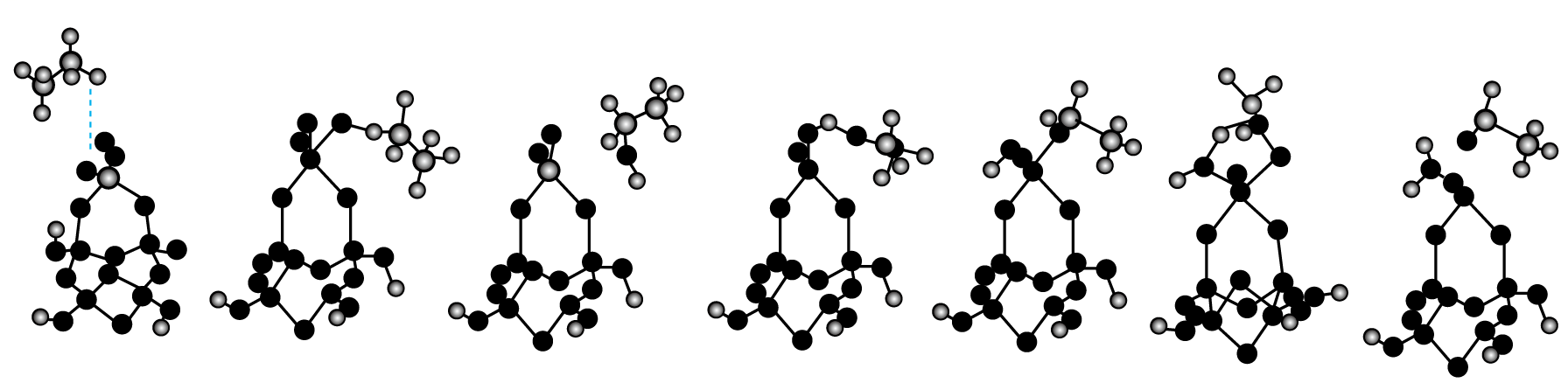
请回答下列问题:
化学键 | C-H | O-H | O=O | C=O | C-C |
键能kJ·mol-l | 413.4 | 426.8 | 497.3 | 750 | 347.7 |
①反应。升高温度活化分子百分数将(填“增大”或“不变”或“减小”)。
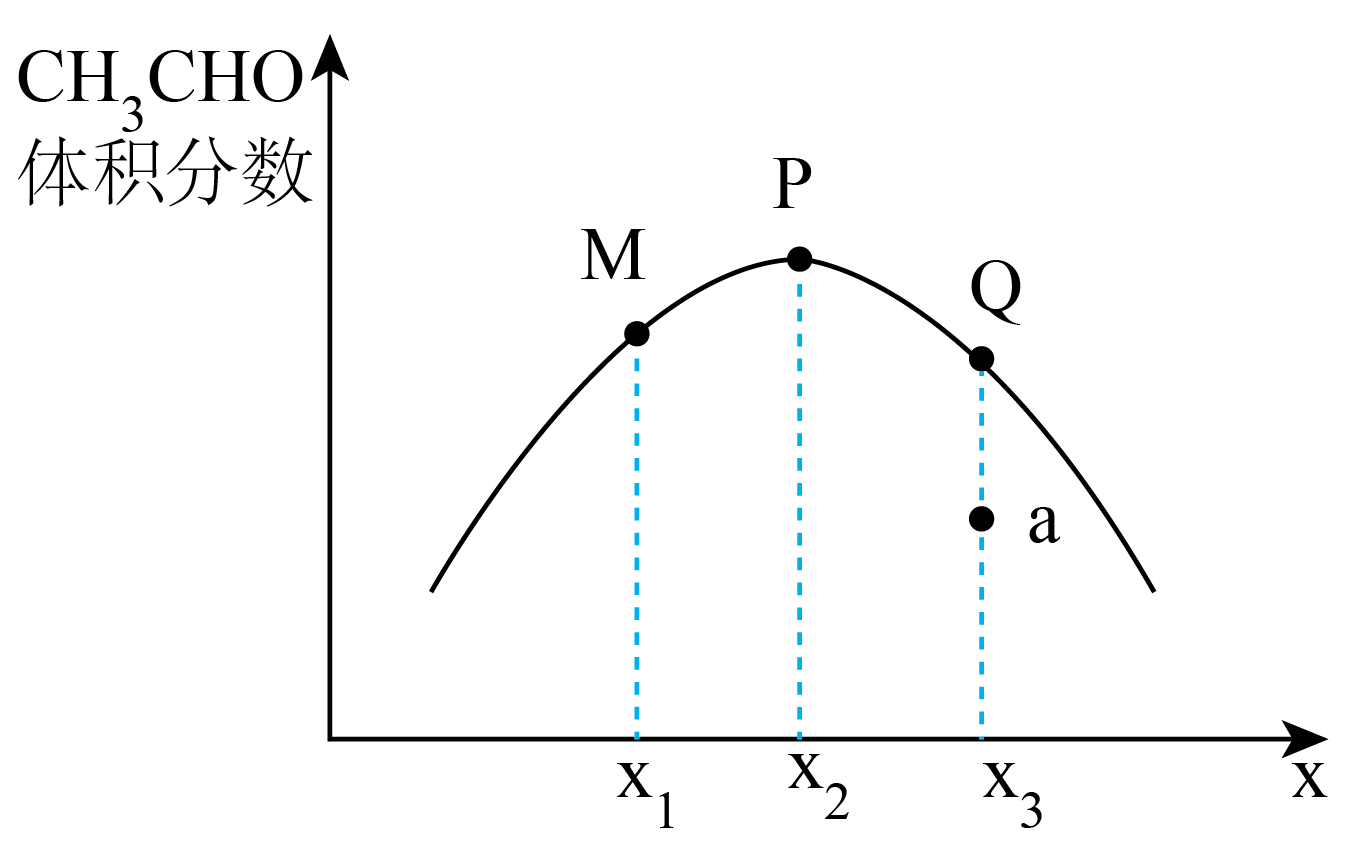
②温度下,在
的刚性密闭容器中按一定比例
加入
和
发生反应,平衡时
的体积分数与
的关系如图所示。图中P点的横坐标
;乙烷转化率最大的是点(填“M”或“P”或“Q”);若要缩短a点至Q点所用的时间,可采取的措施有(答出一条即可)。
①
②
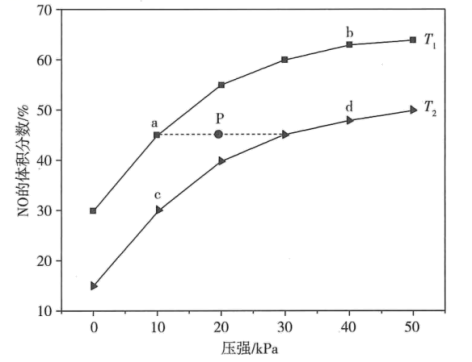
若P点对应的反应容器降温的同时扩大容器体积,重新达到平衡时可能是图中点a、b、c、d中的点。
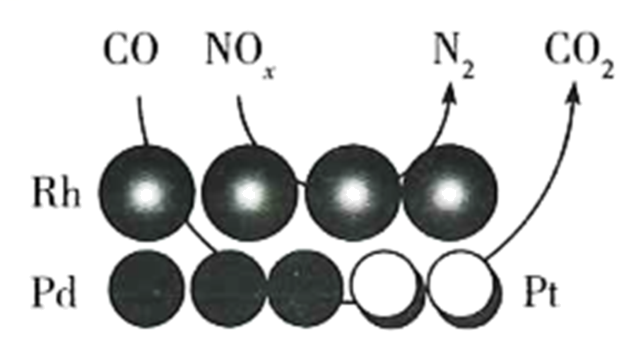
当x=1时,CO和NOx反应中N2与NOx的速率之比为。其他条件相同,增大催化剂比表面积,反应速率(填“增大”“减小”或“不变”)。
为了测定反应级数,测得实验数据如下:
实验 | 反应速率 | ||
a | 0.1 | 0.1 | v |
b | 0.2 | 0.1 | 2v |
c | 0.2 | 0.2 | 8v |
由此推知,m=,n=。
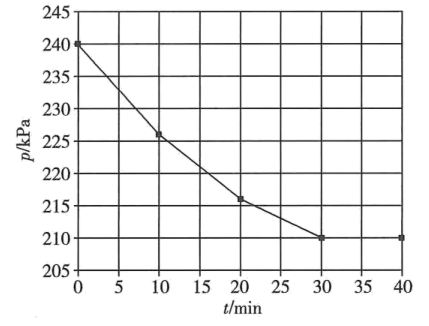
①0~30 min内用H2的分压表示的平均反应速率v(H2)为kPa·min-1。
②该温度下,平衡常数Kp=kPa-1 (Kp为用平衡分压计算的平衡常数,分压=总压×物质的量分数)。
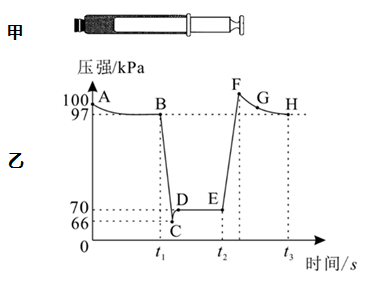
选项 | A | B | C | D |
实验装置 |
|
|
|
|
实验目的 | 蒸发浓缩含有少量稀盐酸的 | 制备 | 探究 | 实验室制备 |