

①
②
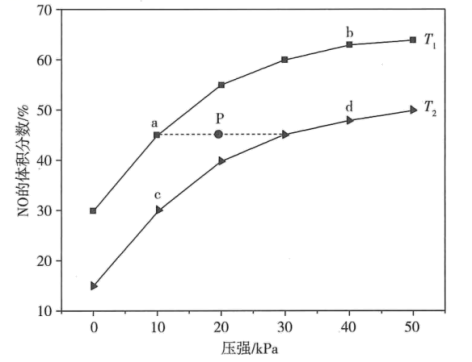
若P点对应的反应容器降温的同时扩大容器体积,重新达到平衡时可能是图中点a、b、c、d中的点。
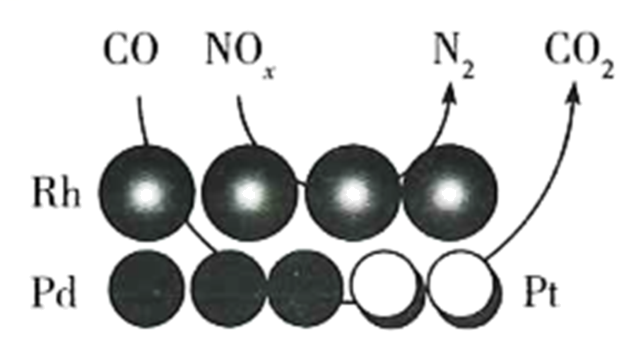
当x=1时,CO和NOx反应中N2与NOx的速率之比为。其他条件相同,增大催化剂比表面积,反应速率(填“增大”“减小”或“不变”)。
为了测定反应级数,测得实验数据如下:
实验 | 反应速率 | ||
a | 0.1 | 0.1 | v |
b | 0.2 | 0.1 | 2v |
c | 0.2 | 0.2 | 8v |
由此推知,m=,n=。
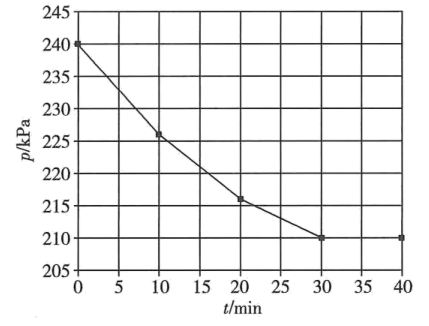
①0~30 min内用H2的分压表示的平均反应速率v(H2)为kPa·min-1。
②该温度下,平衡常数Kp=kPa-1 (Kp为用平衡分压计算的平衡常数,分压=总压×物质的量分数)。