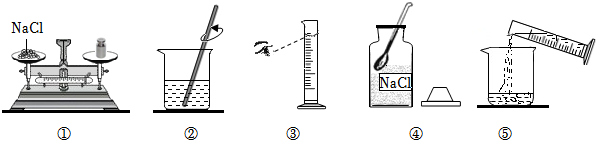
①若用氯化钠固体配制,需称取氯化钠固体7.0g
②用托盘天平称氯化钠固体时,在两盘各放一张质量相等的纸
③选用200mL量筒量取所需水的体积
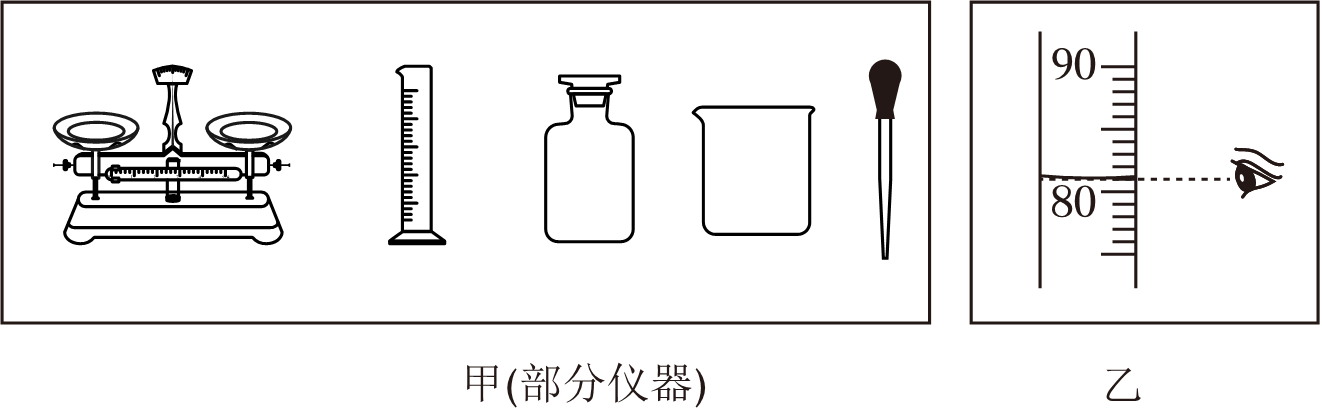
④实验中用到的玻璃仪器有烧杯,量筒、玻璃棒、滴管
⑤用量筒量取水时,俯视读数,配得溶液的溶质质量分数偏小
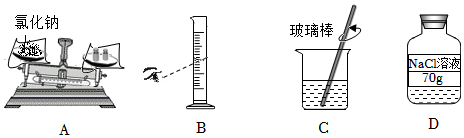
 B . 称量NaOH
B . 称量NaOH C . 量取所需的水
C . 量取所需的水 D . 溶解氢氧化钠
D . 溶解氢氧化钠
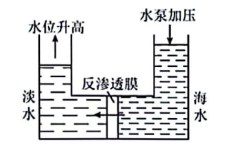
①分离出的浓盐水是(选填“纯净物”或”混合物”)。
②某工厂淡化海水后得到的浓盐水和淡水中盐类物质含量如表(微量盐类忽略不计)。国家规定居民生活用水中盐类物质总含量≤500毫克·升-1 , 计算并推断所得淡水中盐类总含量(选填“达到”或“未达到”)生活用水的标准;该工厂一套淡化装置每小时产生浓盐水300升,其中含有NaCl千克。

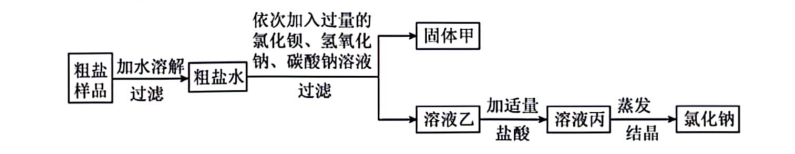
①加适量盐酸的目的是。
②用pH试纸检验溶液丙是否呈中性的操作是。
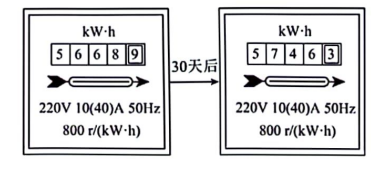
①海洋潮汐发电是利用了海水的能。
②小敏家两次电能表显示如图,他家这30天的用电量为千瓦时。某潮汐发电站发电机日平均发电量44万千瓦时,它最多可供万户类似小敏家庭的日用电。(结果保留整数)
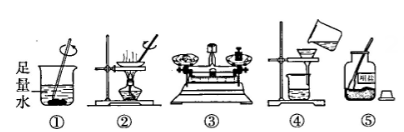

组别 | 1 | 2 | 3 | 4 |
精盐产率 | 75% | 65% | 88% | 72% |
老师对各组的评价是第3 组结果偏高,其他结果都偏低,于是各组分别讨论本组的误差,所找原因正确的是____(填序号)。
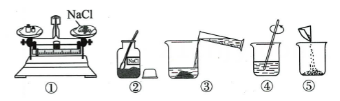
将上述实验配制好的溶液装瓶后贴上标签,在标签上填写:。
A.称量时,药品与砝码放反了,且使用了游码
B.装瓶时,有少量溶液洒出
C.氯化钠固体不纯
D.配制溶液的烧杯内壁沾有水
E.量取水时量筒内事先有少量水
F.将量筒中的水倒入烧杯时有水溅出