①
②
,
。
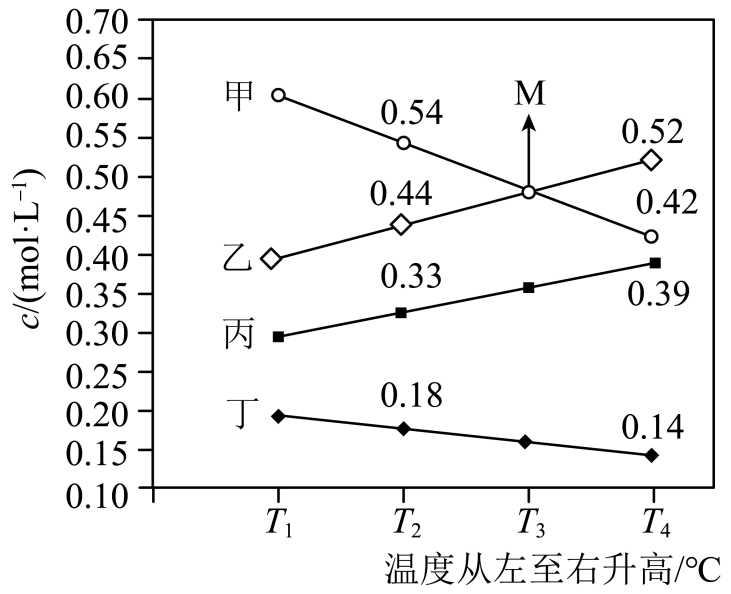
①甲是(填化学式),写出该反应的化学方程式:。
②正反应(填“>”“<”或“=”)0,判断依据是
③T3℃时NH3的平衡转化率为。
选项 | 实验操作 | 现象 | 结论 |
A | 将 | 产生浅黄色沉淀 |
|
B | 向2mL0.1 | 产生红褐色沉淀 | |
C | 将盛有2mL0.5 溶液的试管,先加热,后冷却 | 加热时蓝绿色溶液变为黄绿色,冷却后恢复为蓝绿色 | 反应 |
D | 加热试管中的聚氯乙烯薄膜碎片 | 试管口润湿的蓝色石蕊试纸变红 | 氯乙烯加聚铈可逆反应 |

已知:①;
②焦亚硫酸钠()常用作食品抗氧化剂;
③氧化性:。
回答下列问题:
a.CoO
b.
c.KOH


选项 | 实验操作及现象 | 结论 |
A | 向重铬酸钾溶液中加水,溶液颜色变浅 | 增加水的用量,平衡 |
B | 向含酚酞的 |
|
C | 向硫酸铜溶液中滴加浓氨水至过量,溶液先产生蓝色沉淀,然后沉淀溶解变为深蓝色溶液 |
|
D |
|
|
已知:该反应![]() 焓变和熵变受温度影响很小,可视为常数。200℃时,该反应____自发进行。
焓变和熵变受温度影响很小,可视为常数。200℃时,该反应____自发进行。

①420℃时NO转化率低于390℃时NO转化率的原因可能是。
②B点(填“是”或“否”)达到化学平衡状态,理由是。
状态 | 热值(kJ/g) | 沸点(℃) | 密度(kg/L) | 液态能量密度(MJ/L) | |
氨气 | 气 | 18.6 | -33 | 0.6820 | 12.7 |
氢气 | 气 | 120 | -253 | 0.0708 | 8.5 |
氮元素燃烧后生成的稳定产物为N2。请书写NH3燃烧的热化学方程式。
直接脱氢:
氧化脱氢:
①
②
保持压强为20kPa条件下,按起始投料 , 匀速通入装有催化剂的反应器中发生反应①和②,测得不同温度下
和
的转化率如右图实线所示(图中虚线表示相同条件下平衡转化率随温度的变化)。

表示转化率的曲线是(填“m”或“n”)。
反应Ⅰ:
反应Ⅱ:
在密闭容器中通入3mol 和2mol
, 假设只发生反应Ⅰ和Ⅱ,分别在0.2MPa和2MPa下进行反应,其中
和
的平衡体积分数随温度变化如图所示。

已知:对于反应Ⅱ, ,
,
、
为速率常数,只与温度有关,分压=总压×物质的量分数。下列说法不正确的是( )
选项 | 实验 | 现象 | 结论 |
A | 向两份等体积等浓度的新制氯水中,分别滴加AgNO3溶液和淀粉KI溶液 | 前者产生白色沉淀,后者溶液变为蓝色 | 氯气与水的反应存在限度 |
B | 将苯与液溴在催化剂作用下产生的气体通入硝酸银溶液中 | 产生淡黄色沉淀 | 苯和液溴发生取代反应 |
C | 向1mL0.01mol·L-1MgCl2溶液中滴入2滴0.01mol·L-1NaOH溶液,产生白色沉淀,再滴入2滴0.01mol·L-1CuSO4溶液 | 白色沉淀逐渐变为蓝色沉淀 | Ksp[Cu(OH)2]<Ksp[Mg(OH)2] |
D | 向溶有SO2的CaCl2溶液中通入气体X | 产生白色沉淀 | X一定具有强氧化性 |
反应ⅰ:
反应ⅱ:
向密闭容器中通入的混合气体,在不同压强(
、
)、不同温度下,平衡体系中
的转化率、
和CO的选择性随温度的变化如图所示。
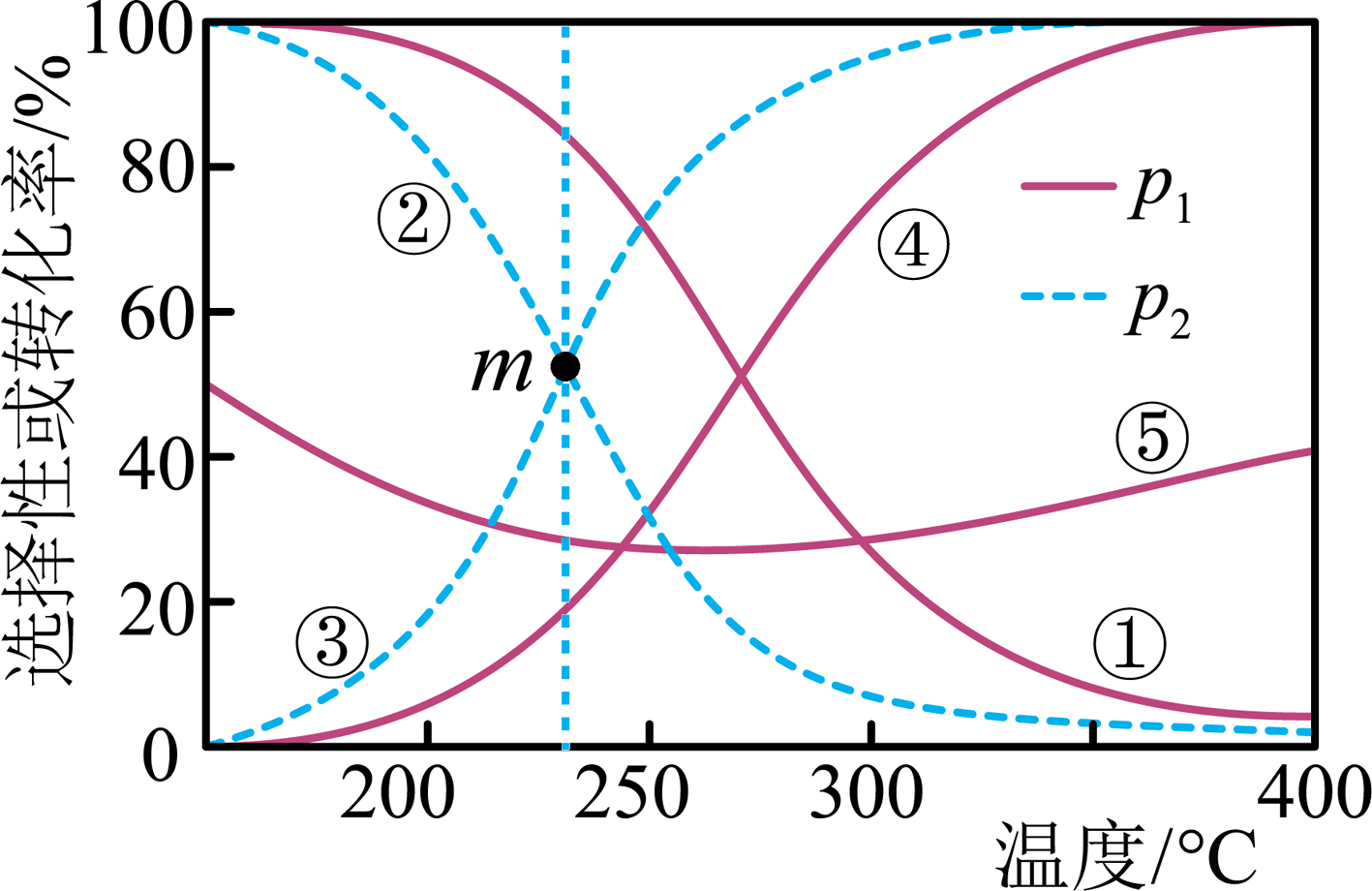
下列说法错误的是( )