实验或实验操作 | 现象 | 实验结论 | |
A | 用大理石和盐酸反应制取CO2气体,立即通入一定浓度的Na2SiO3溶液中 | 出现白色沉淀 | H2CO3的酸性比H2SiO3的酸性强 |
B | 向某溶液先滴加硝酸酸化,再滴加BaCl2溶液 | 有白色沉淀生成 | 原溶液中含有SO42-、SO32-、HSO3-中的一种或几种 |
C |
| 试管b比试管a中溶液的红色深 | 增大反应物浓度,平衡向正反应方向移动 |
D |
| 左边棉球变为橙色,右边棉球变为蓝色 | 氧化性:Cl2>Br2>I2 |

回答下列问题:
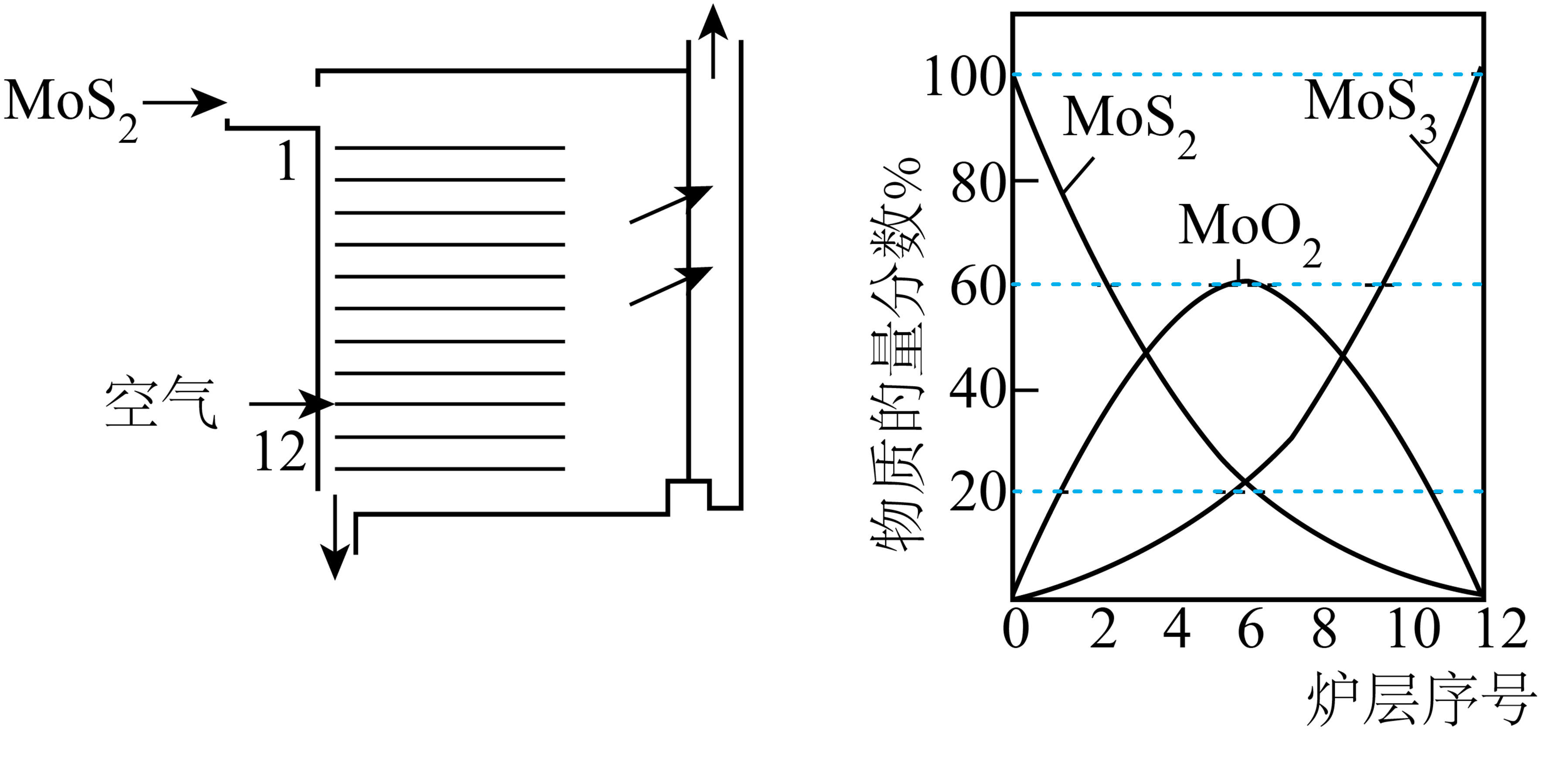
①多层逆流焙烧的优点是(任答一点)。
②固体1的成分有、CuO和Fe2O3。
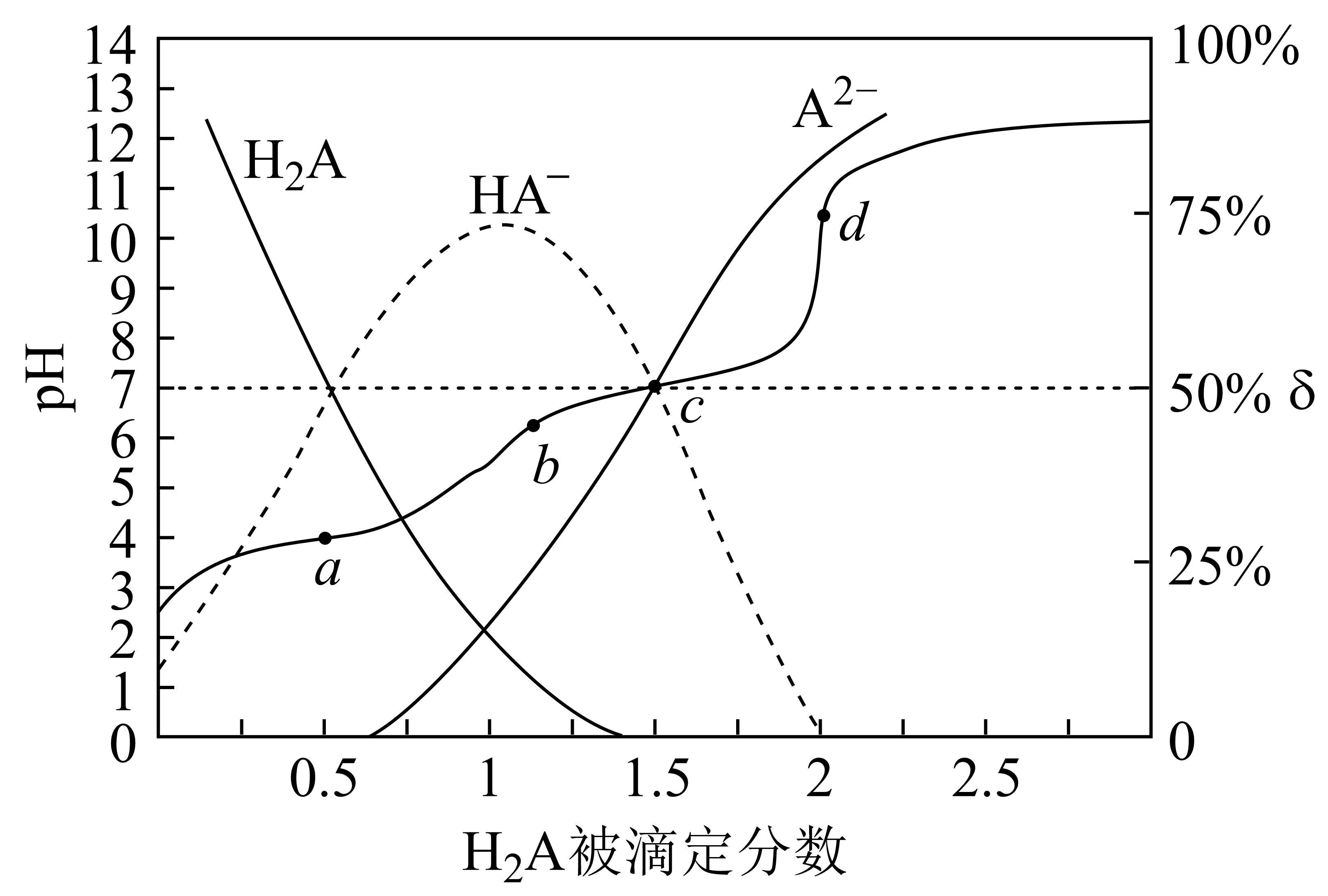
下列说法正确的是( )
实验目的 | 实验方案设计 | 现象 | 结论 | |
A | 探究 | 向 | 溶液变蓝色 | 氧化性: |
B | 比较 | 常温,测定 | 结合 | |
C | 探究温度对化学平衡的影响 | 将 | 加热后溶液为黄绿色,冷水中变为蓝绿色 | 说明降低温度
|
D | 比较AgCl与 | 向含有浓度均为 | 先生成白色AgCl沉淀 | Ksp: |