

②用量筒来量取所需的水(水的密度为1g/cm3),量筒的规格是(从下列中选用:10mL、50mL、100mL)。
③用托盘天平称量所需的氯化钠时,发现托盘天平的指针偏向左盘,应。
A.增加适量氯化钠固体 B.减少适量氯化钠固体
C.调节游码 D.添加砝码
①用量筒量取水时,俯视读数 ②试剂、砝码的左右位置颠倒且使用游码
③用量筒量取水时,仰视读数 ④用于溶解的烧杯中有少量的蒸馏水
⑤转移溶液时有部分体溅出
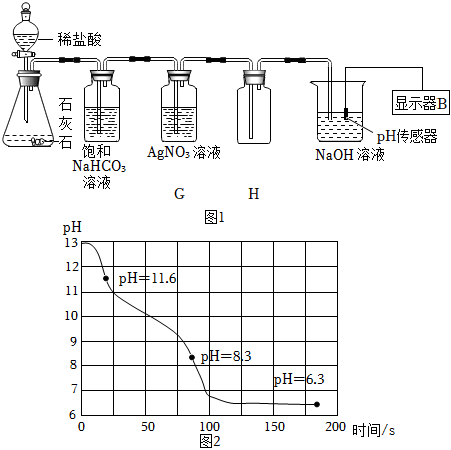
已知:此实验条件下Na2CO3溶液的pH≈11.6,NaHCO3溶液的pH≈8.3。
①装置G的作用是 。
②实验50s时装置H溶液中的溶质是 。
③实验150s时显示器中曲线pH<7的原因是 。

①16.0g甲烷理论上可制备氢气的质量为 g。
②“分离“时发生反应的化学方程式为 。
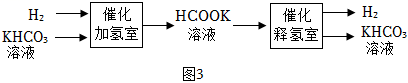
①催化加氢室发生反应的化学方程式为 。
②采用HCOOK溶液释氢优于HCOOH释氢,原因有产生H2的速率快和 。
③在氢气的贮存和释放中可循环使用的物质是 。