t℃ | 200 | 300 | 400 |
K | K1 | K2 | 0.5 |
请完成下列问题:
①试比较K1、K2的大小,K1K2(填">”、“<”或“=”);
②400℃时,反应2NH3(g)N2(g)+ 3H2(g)的化学平衡常数为。当测得NH3、N2和H2物质的量分别为3mol、2mol和2mol时,则该反应的v(N2)正 v(N2)逆(填“>” “<”或“=”)。
已知:N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-544kJ/mol,键能数据如下表:
化学键 | N-N | N-H | O=O | O-H |
键能/(kJ/mol) | 193 | 391 | 497 | 463 |
则氮氮三键的键能为kJ/mol。
A.在250 mL容量瓶中配制250 mL烧碱溶液
B.用移液管(或碱式滴定管)量取25.00 mL烧碱溶液于锥形瓶中并加几滴甲基橙指示剂
C.在天平上准确称取烧碱样品w g,在烧杯中加蒸馏水溶解
D.将物质的量浓度为m mol/L的标准H2SO4溶液装入酸式滴定管,调整液面,记下开始刻度V1 mL
E.在锥形瓶下垫一张白纸,滴定到终点,记录终点刻度为V2 mL
请完成下列问题:
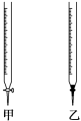
下表中选出正确选项( )
锥形瓶中溶液 | 滴定管中溶液 | 选用指示剂 | 选用滴定管 | |
A | 碱 | 酸 | 石蕊 | 乙 |
B | 酸 | 碱 | 酚酞 | 甲 |
C | 碱 | 酸 | 甲基橙 | 甲 |
D | 酸 | 碱 | 石蕊 | 乙 |
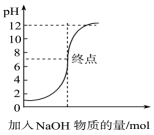
选项 | A | B | C | D |
强电解质 | HNO3 | NaCl | BaSO4 | 盐酸 |
弱电解质 | CH3COOH | NH3 | H3PO4 | Fe(OH)3 |
非电解质 | C6H12O6(葡萄糖) | CO2 | C2H5OH | H2O |
 B .
B .  C .
C .  D .
D . 