某同学模拟工艺流程,制备碳酸氢钠,实验装置如图所示(图中夹持、固定用的仪器未画出)。
已知:NH3极易溶于水,溶液呈碱性。

请回答:
a.碳酸氢钠难溶于水
b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
操作:取少量试样溶于水中,再滴加。
现象:。
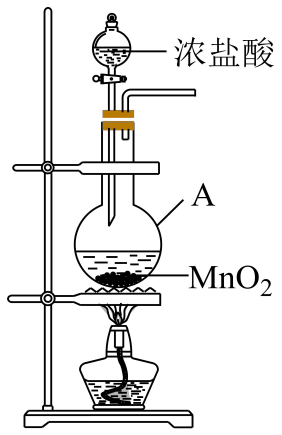
仪器A的名称为;A中反应的离子方程式为;
A  B.
B.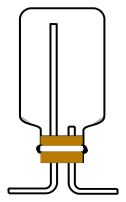 C.
C.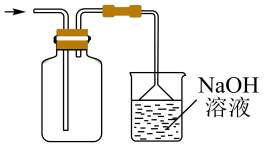 D.
D.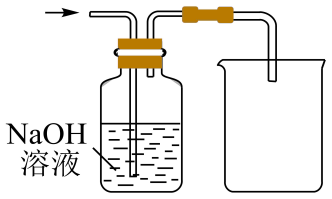
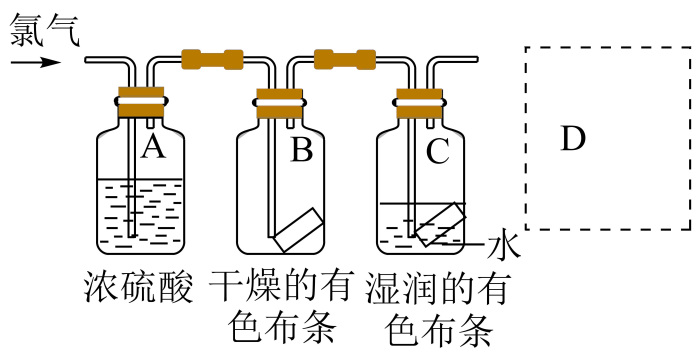
①浓的作用是;
②与研究目的直接相关的实验现象是,并解释产生上述现象的原因;
③该实验设计存在事故隐患,应在D处增加一装置,该装置![]() 作用是。
作用是。
酸 | 电离平衡常数 |
醋酸 | |
碳酸 |
|
亚硫酸 |
|
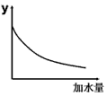
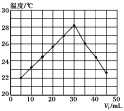
a.溶液的pH b.醋酸的电离平衡常数
c.溶液的导电能力 d.醋酸的电离程度
Ka2
Kh2 (水解平衡常数,表示水解程度)
已知25 ℃时,Ka2 > Kh2 , 则0.1 mol∙L−1 NaHSO3溶液呈(填“酸性”“碱性”或“中性”);其中c(Na+)c()(填“>”“<”或“=”);其电荷守恒表达式可写为。