根据以下应用回答有关问题:
元环。试画出S8的八元环结构式。
已知多硫化钙为离子化合物,其中S原子以S—S单键连接成多硫链而形成—2价的原子团,试画出五硫化钙的电子式。
共价键 | C=O | C=S | H—O | H—S |
键能/kJ.mol-1 | 745 | 536 | 464 | 339 |
根据有关反应原理写出硫化羰气体与水蒸气反应生成CO2和H2S的热化学方程式:.

①H2S2的名称是。
②电极b为(选填“正极”、 “负极”)。
③电极a上发生的电极反应为:。
该制备反应的化学方程式为;
已知S2O常温时分解生成两种含硫的常见物质,请依据S2O中硫元素的价态分析并写出该分解反应的化学方程式。

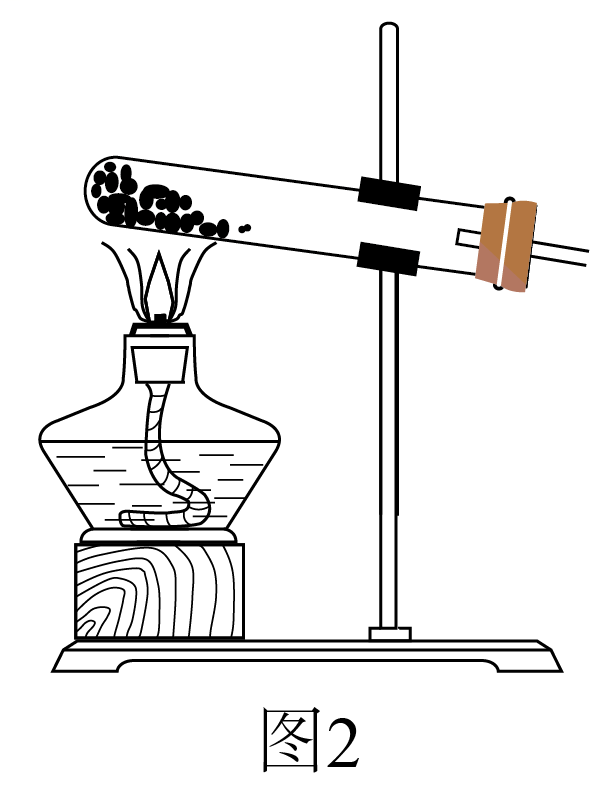
①简述使用分液漏斗向圆底烧瓶中滴加浓硫酸的操作:。
②实验过程中,需要通入氧气。试写出一个用如图2所示装置制取氧气的化学方程式:。
③当停止通入SO2熄灭酒精灯后,需要继续通一段时间的氧气,其目的是:。
④实验结束后,若装置D增加的质量为mg,装置E中产生白色沉淀的质量为ng,则此
条件下二氧化硫的转化率是(用含字母的代数式表示,不用化简)。
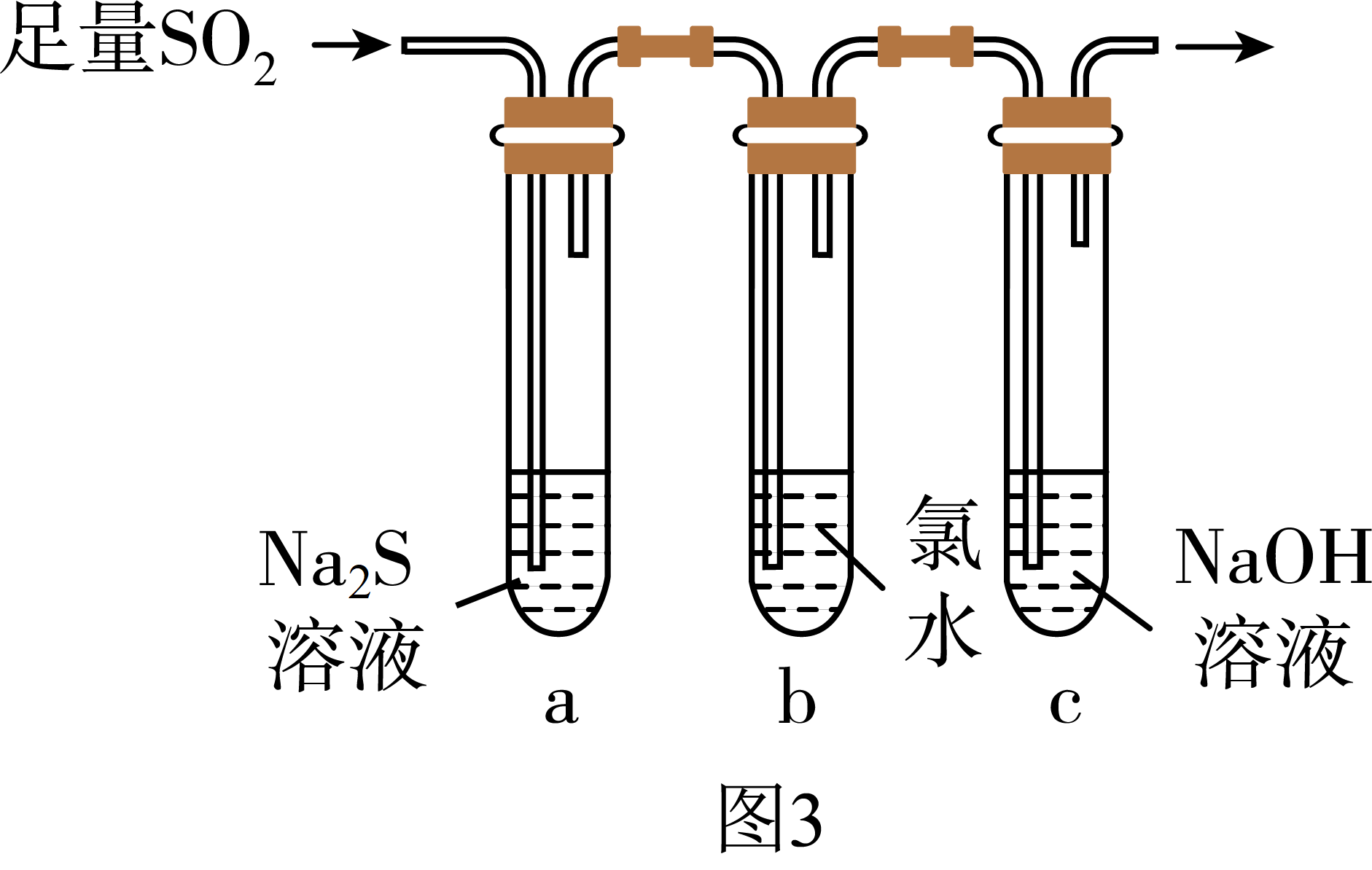
①能说明二氧化硫具有氧化性的实验现象为: 。
②为验证二氧化硫的还原性,充分反应后,取试管b中的溶液分三份,分别进行如下实验。
方案I:向第一份溶液中加入AgNO3溶液,有白色沉
淀生成。
方案Ⅱ:向第二份溶液中加入品红溶液,红色褪去。
方案Ⅲ:向第三份溶液中加入BaCl2溶液,产生白色沉淀
上述方案中合理的是 (填“I”、“Ⅱ”、或“Ⅲ”);
试管b发生反应的离子方程式:。
③当通入二氧化硫至试管c中溶液显中性时,该溶液中
c(Na+)=用含硫微粒浓度的代数式表示)。

回答下列问题:
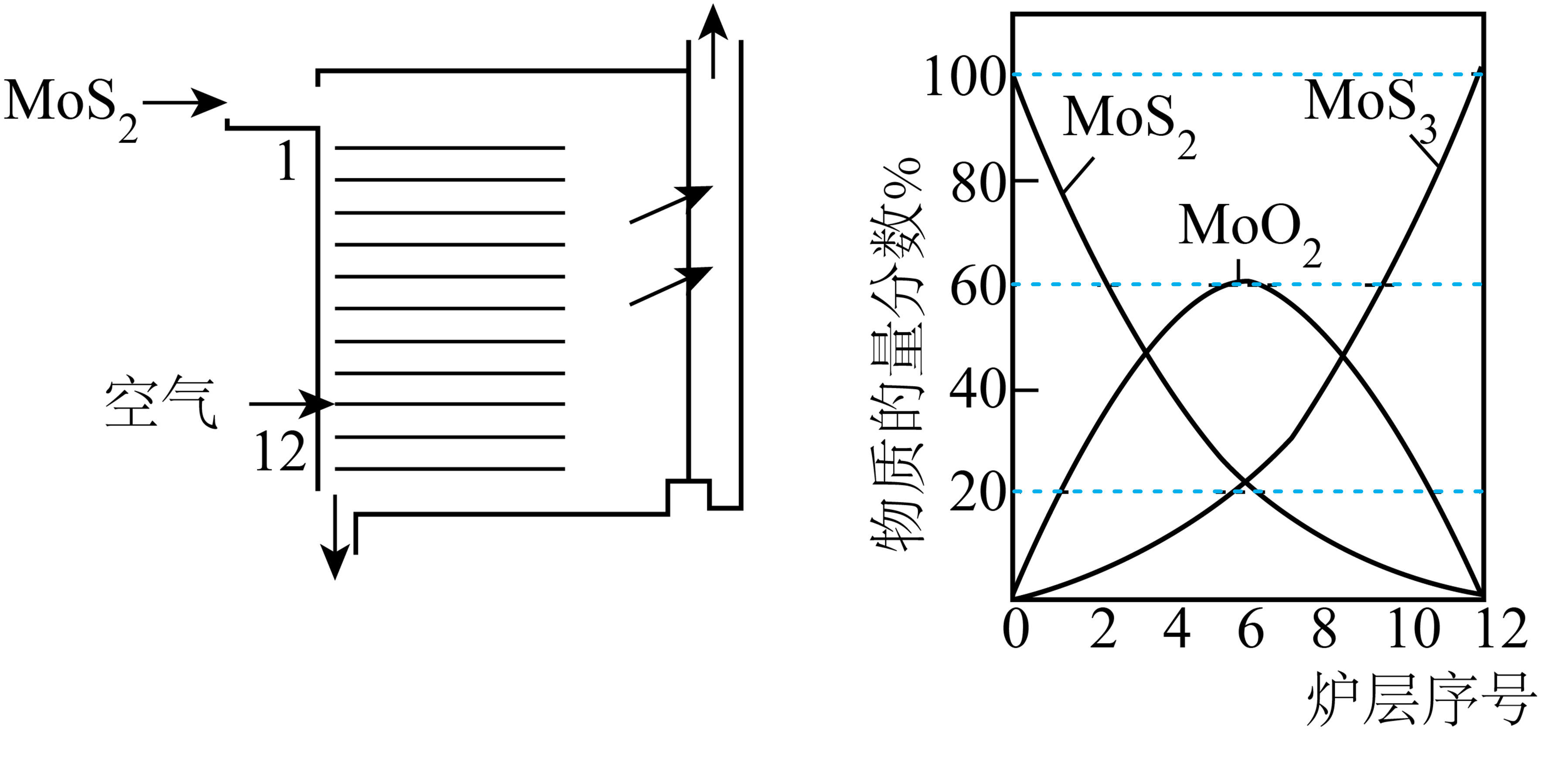
①多层逆流焙烧的优点是(任答一点)。
②固体1的成分有、CuO和Fe2O3。
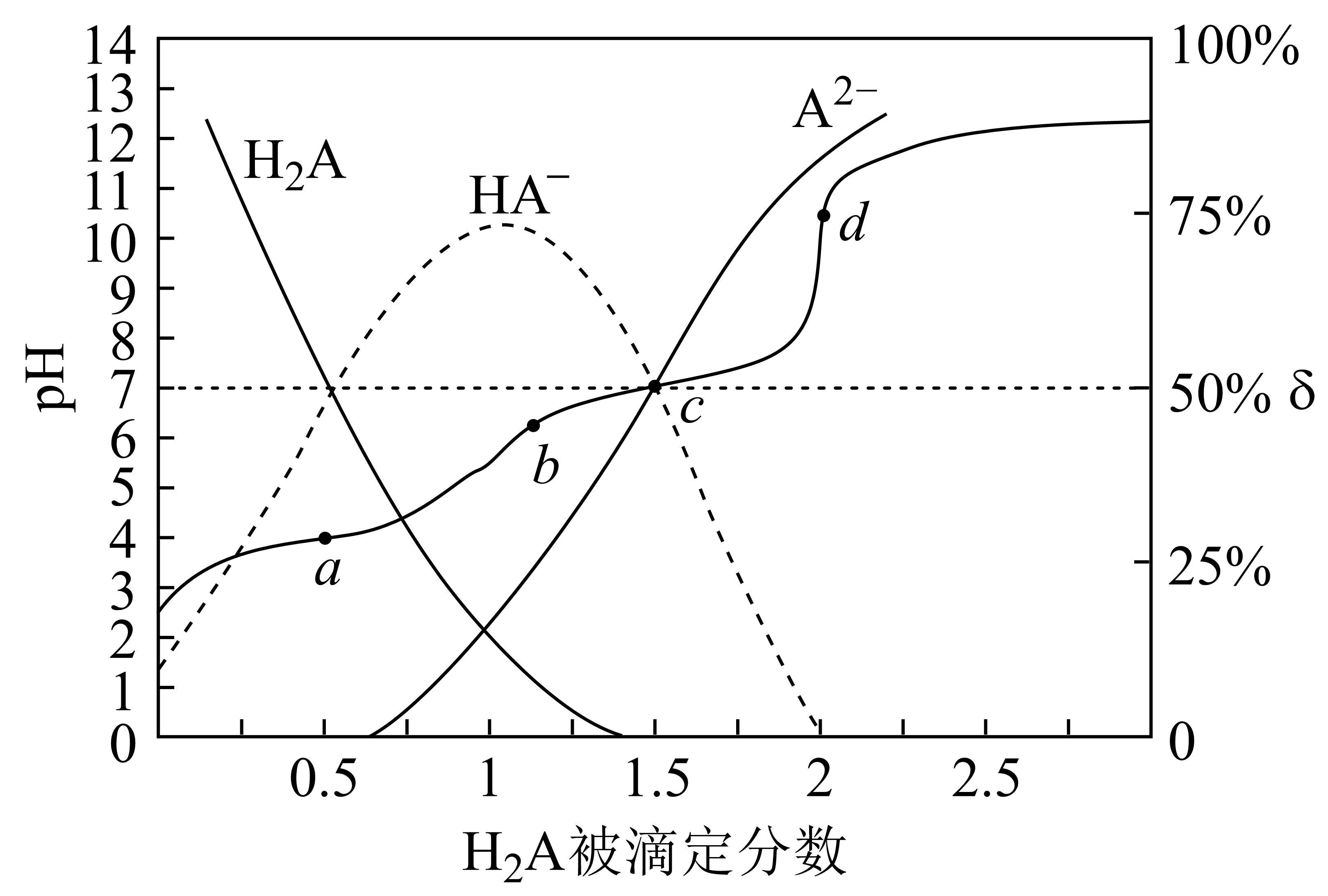
下列说法正确的是( )

图a装置 | 图b装置 | 图c装置 | |
80s时反应区 | x |
下列说法正确的是( )